この本や記事で分かること
・原子の結合の種類
・それぞれの結合の種類による違い
原子の結合にはどんな種類があるのか
原子は単体で存在しているだけでなく、同じ原子同士や他の原子と様々な形で結合しています。
原子同士の結合は化学結合と呼ばれ、イオン結合、共有結合、金属結合の3種類に大きく分けられます。
3つの結合にも、電子が大きくかかわっています。
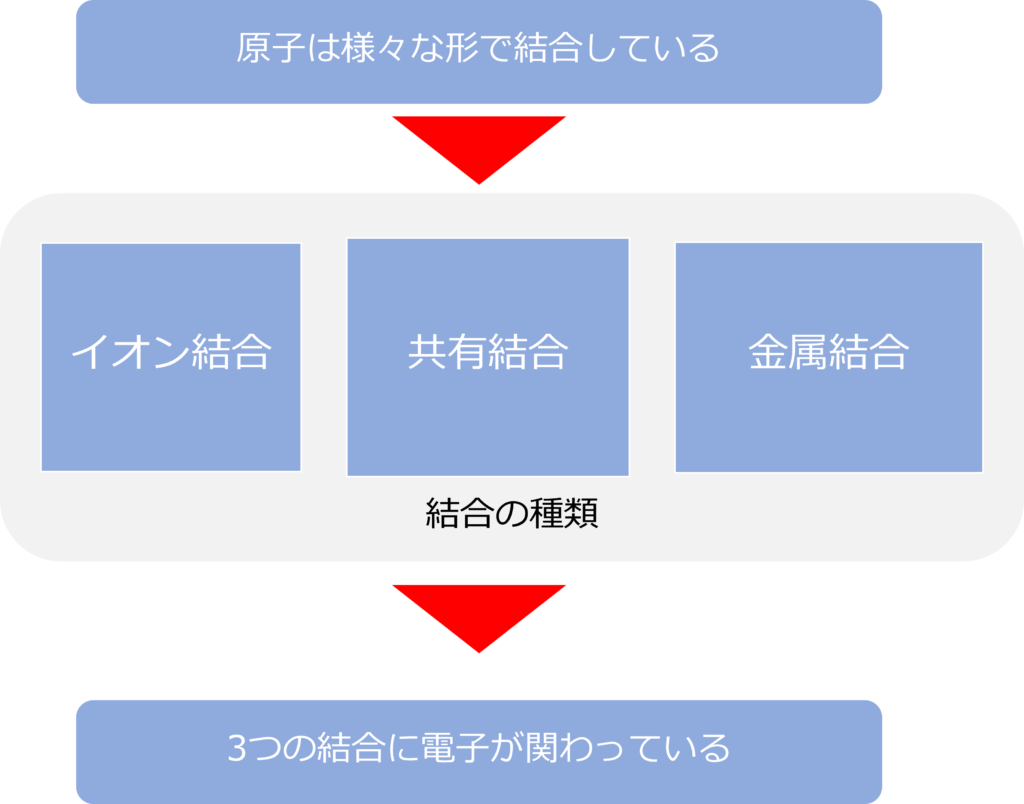
イオン結合とは何か
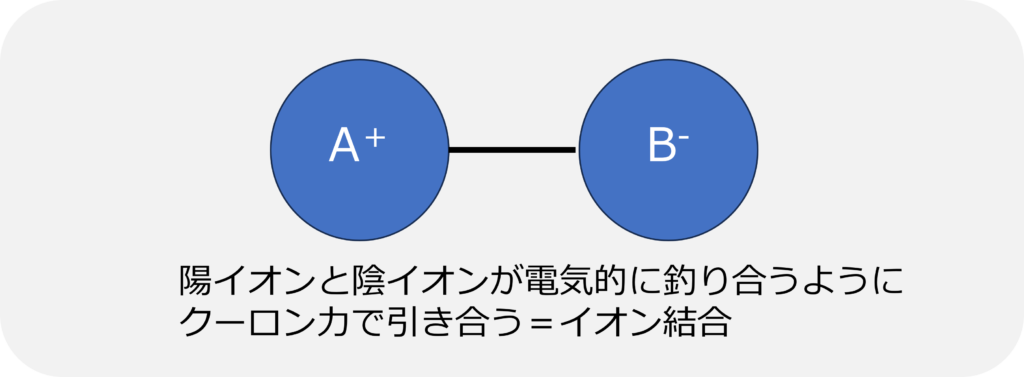
電子を放出しやすい化合物と電子を受け取りやすい物質で作られる結合はイオン結合です。
イオン結合は電子を失った陽イオンと電子を得た陰イオンが電気的に釣り合うように、静電気的な力(=クーロン力)で引き合うことで結合しています。
多くのイオン性物質は金属の陽イオンと陰イオンからできており、イオン性化合物は塩とも呼ばれます。
水はイオンの引き合う力を結晶状態の時と比較して、大きく低下させるため、水の中ではイオン性物質は陽イオンと陰イオンに分かれやすくなります。
そのため、イオン性物質は水に溶けるものが多く、水の中では陽イオンと陰イオンがばらばらの状態で存在しています。
電子はどのように配置されているのか
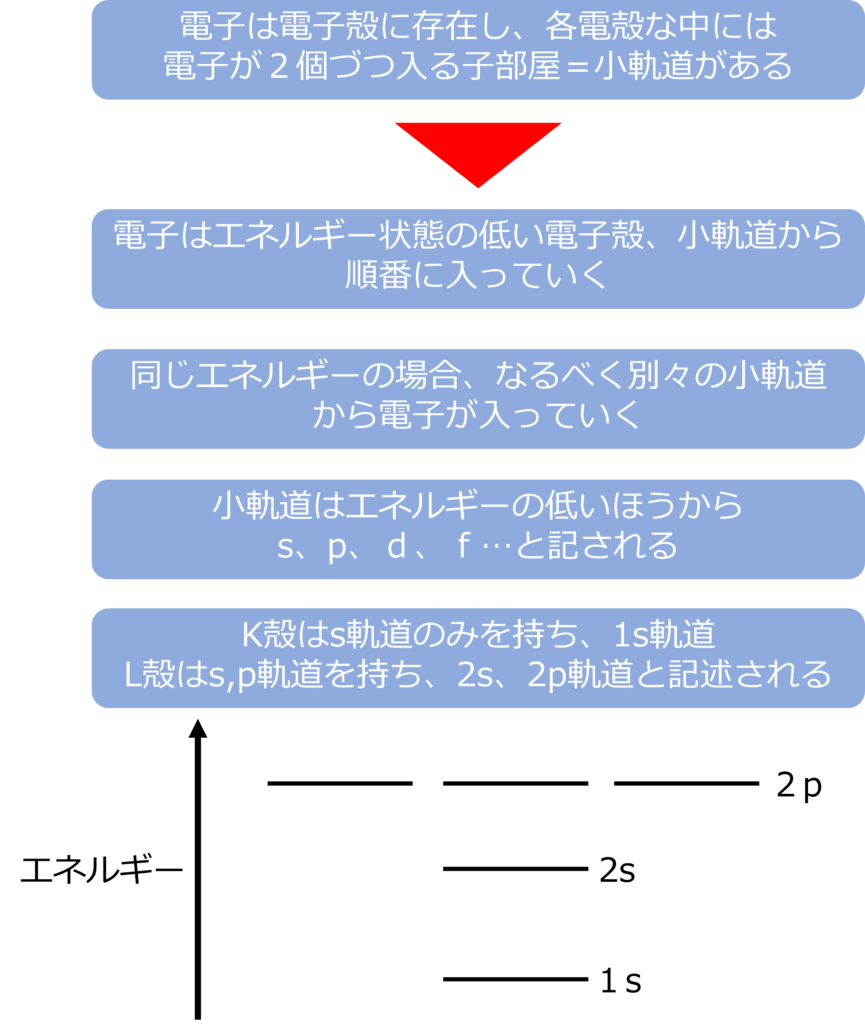
電子は電子殻に存在し、各電子殻に入ることでのできる上限が決まっており、K殻には2個、L殻には8個、M殻には18個の電子が入ることができます。
各軌道の中はさらに細かい部屋(小軌道)に分かれており、各部屋には2つづつ電子の入ることできます。L殻であれば2個入る小軌道が4つあり、合計8つの電子入ることができます。
電子が小軌道に入るルールは、電子はエネルギーの低い位置にある電子殻から入っていき、同じ電子殻内で、電子はなるべく別々の小軌道に入るといったことが挙げられます。
小軌道はエネルギーの低いほうからs、p、d、f…と記されます。
K殻はs軌道のみを持ち、最も原子核から近いため1s軌道とし、L殻はs軌道とp軌道を持ち、それぞれ、2s、2p軌道と記述されます。
水素や炭素はどのような電子配置になっているのか
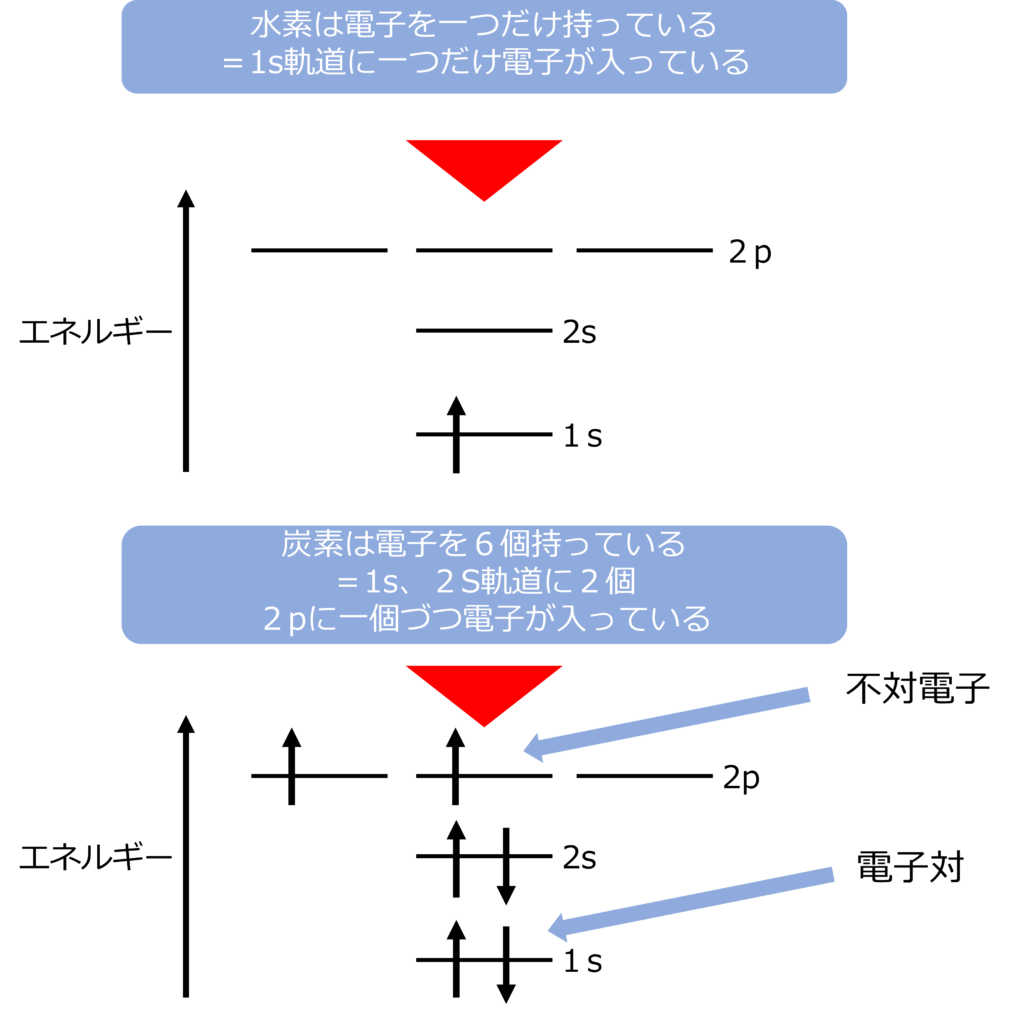
水素は電子を一つだけもっているため1s軌道に一つだけで電子が入っています。
炭素の6個の電子をもっています。K殻には2個電子が入ることができるので、K殻はいっぱいになっています。
残り4個の電子は2個がエネルギーの低い2s軌道に、残りの2個の電子は3つの2p軌道のうち、2つに
窒素は7個の電子を持っており、K殻はいっぱいで、残りの5個はL殻に入っています。2s軌道に2個が入り、残り3つの電子が3つの2p軌道に分かれて入っています。
軌道にひとつしか電子が入っていない場合、その電子は不対電子、二つ入っている場合は、電子対と呼びます。
なぜ、軌道に入る電子は二つなのか
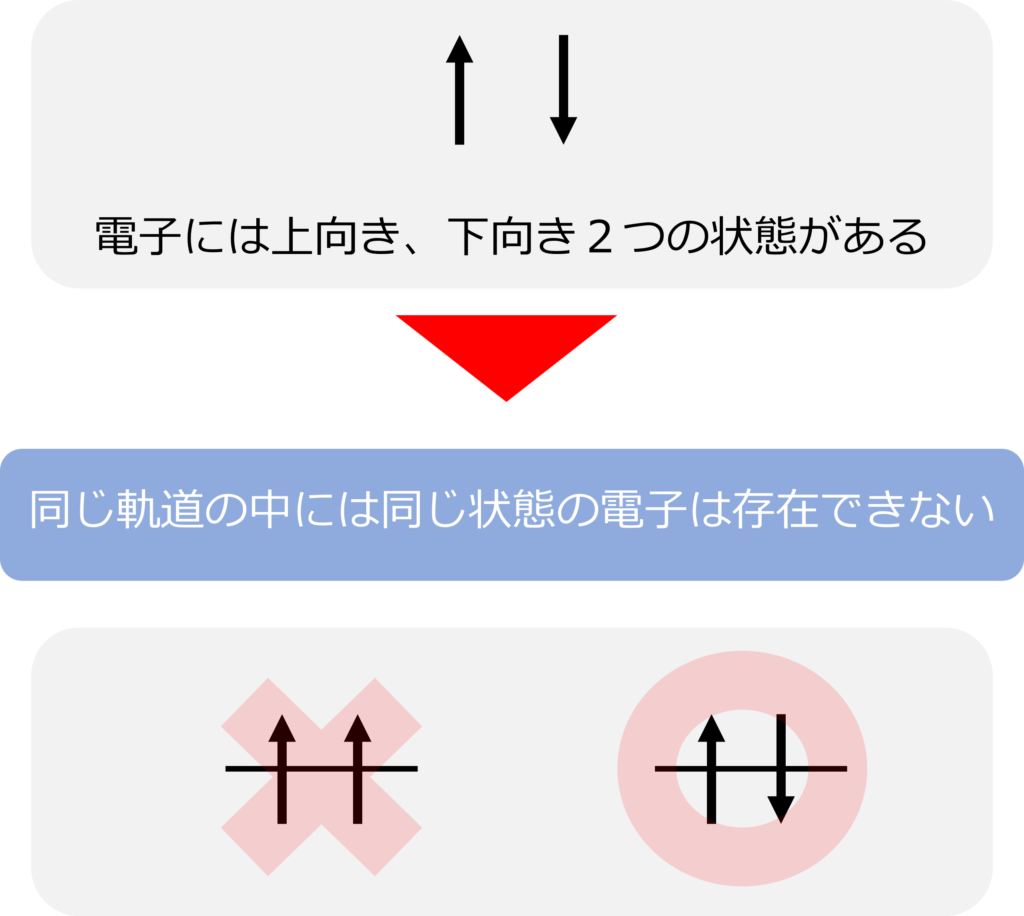
一つの軌道に電子は2個しか入ることができません。
これは、同じ軌道内に存在できる電子の状態が1つだけであることが理由です。
電子には上向きのスピンとと下向きのスピンの2つの状態が存在しているため、同じ軌道内に上向きスピンの電子と下向きスピンの電子の二つの電子が入ることが可能です。
電子のスピンは上向きと下向きの2種類しかないため、3つ以上の電子が軌道に入ることは不可能です。
共有結合とはどんな結合なのか
不対電子は電子対と比較して、高いエネルギー状態であり、不安定です。また、電子殻は希ガスと同じ電子配置になることで、より安定な状態になろうとする性質も持っています。
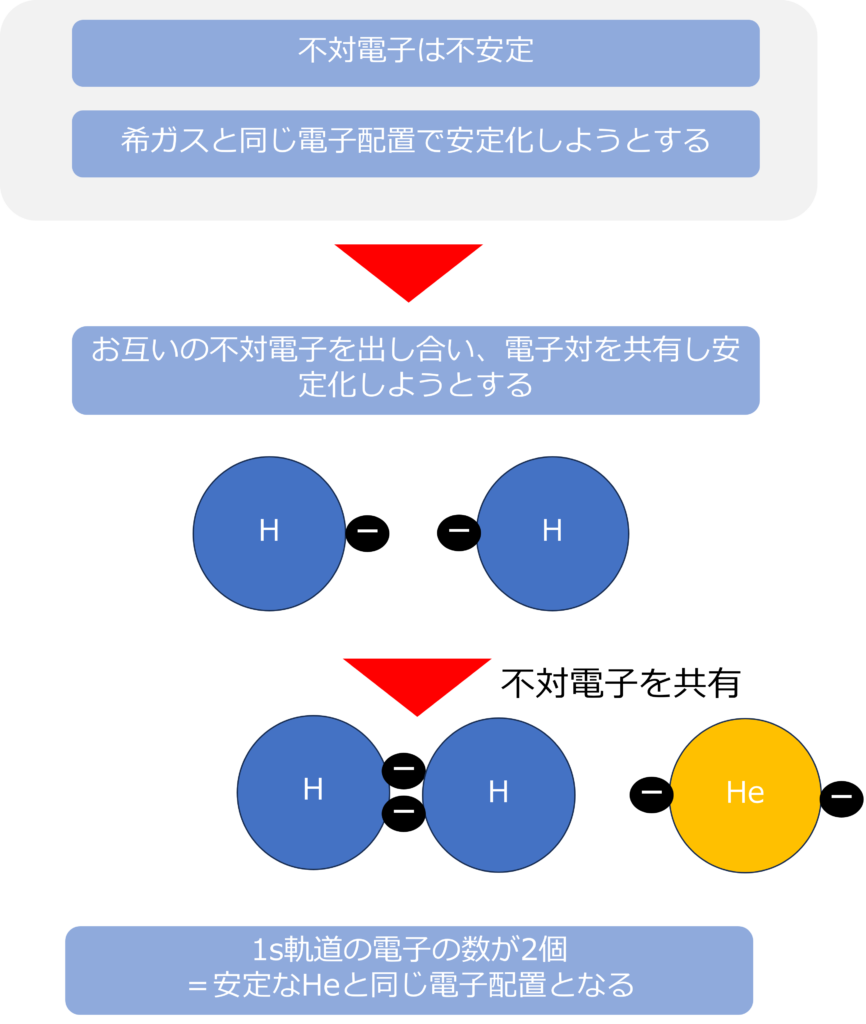
そのため、なるべく電子対を形成しようとします。お互いの不対電子を出し合うことで、形成された結合を共有結合と呼びます。
水素原子はそれぞれの1つある不対電子を共有して、共有結合を形成しています。
2つの水素原子が結合し、電子を共有することで、軌道中の電子数は2個となり、希ガスでありヘリウムと同じ電子配置になるため、
窒素原子は不対電子を3つ持っています。そのため窒素分子はお互いの不対電子を共有し、3組の共有結合を形成します。
水素のように1つの共有電子対からなる結合を単結合、2組の場合は二重結合、窒素のように3組の場合は3重結合と呼ばれます。
水分子はどのように共有結合を作っているのか
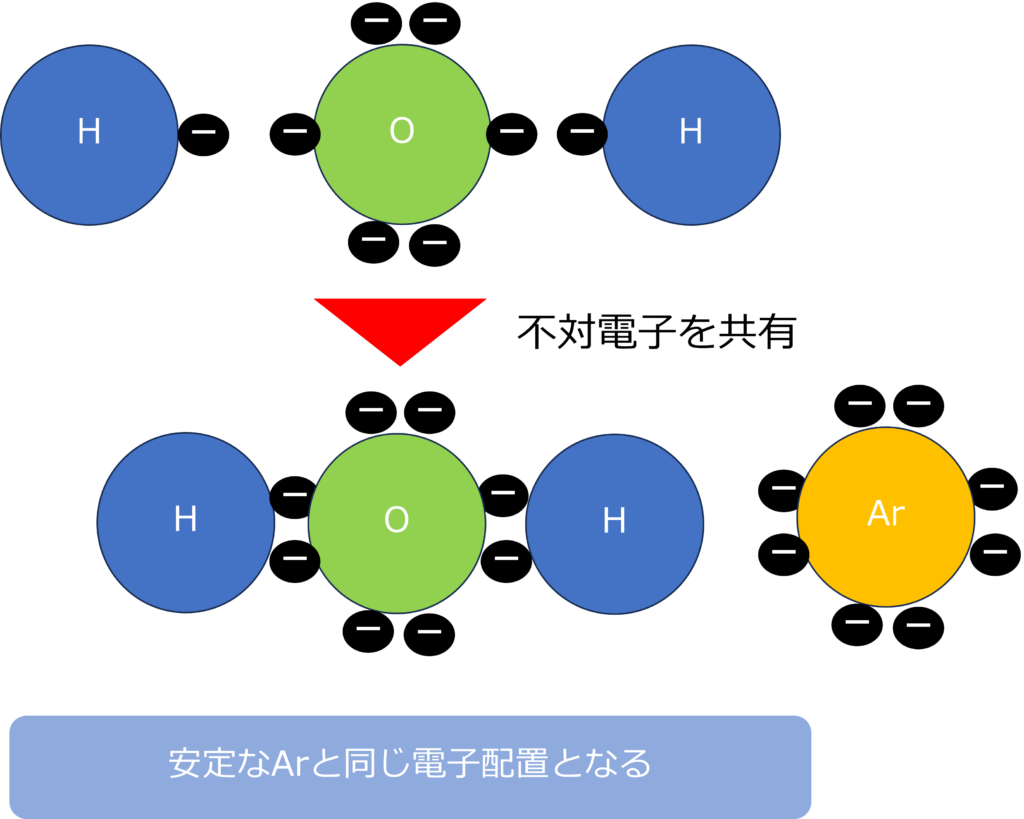
単体だけでなく、化合物であっても、希ガスと同じ電子配置になっているという点は変わりません。
酸素は2個の不対電子を、水素は1個の不対電子をもっています。そのため、水分子は酸素1つと水素2つが不対電子を共有することで電子数が8個となり、希ガスであるネオンと同じ電子配置になることができます。
炭素は4個の不対電子を持ち、酸素は2個の不対電子を持っています。そのため、二酸化炭素は炭素1つと酸素2つは2個づつの不対電子を共有し、2つの2重結合を形成しています。
金属結合はどんな結合なのか
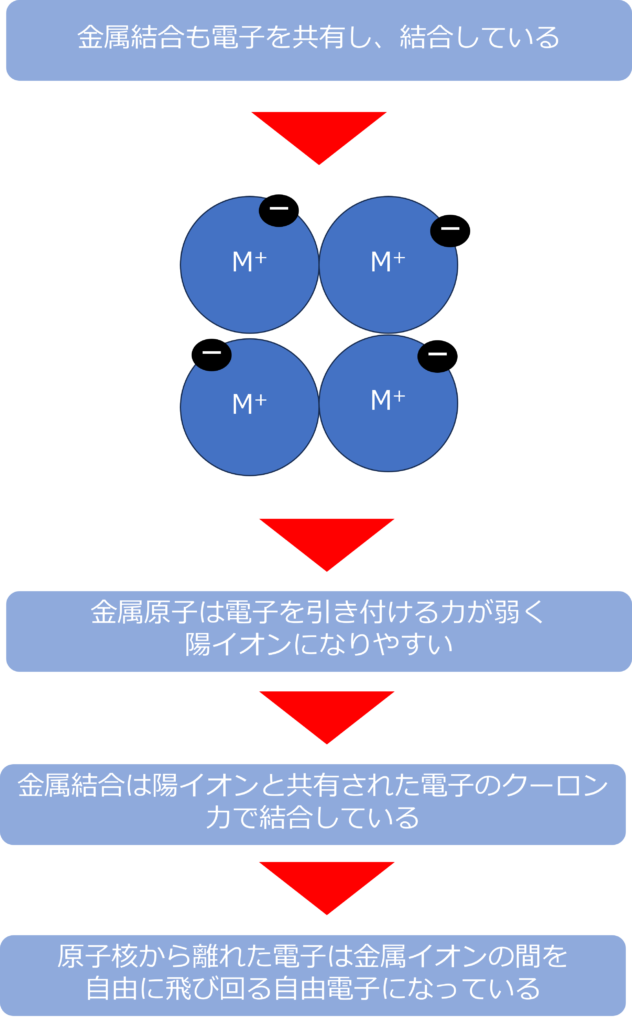
金属原子も集まると、電子を共有することで、結合していますが、その仕組みは共有結合とは異なっています。
金属原子は電子を引き付ける力が弱いため、陽イオンになりやすい傾向あります。原子核から離れた電子は金属イオンの間を自由に飛びまわり、自由電子と呼ばれる状態になります。
金属結合は複数の金属原子で共有された自由電子と金属イオンの間のクーロン力で結合しています。
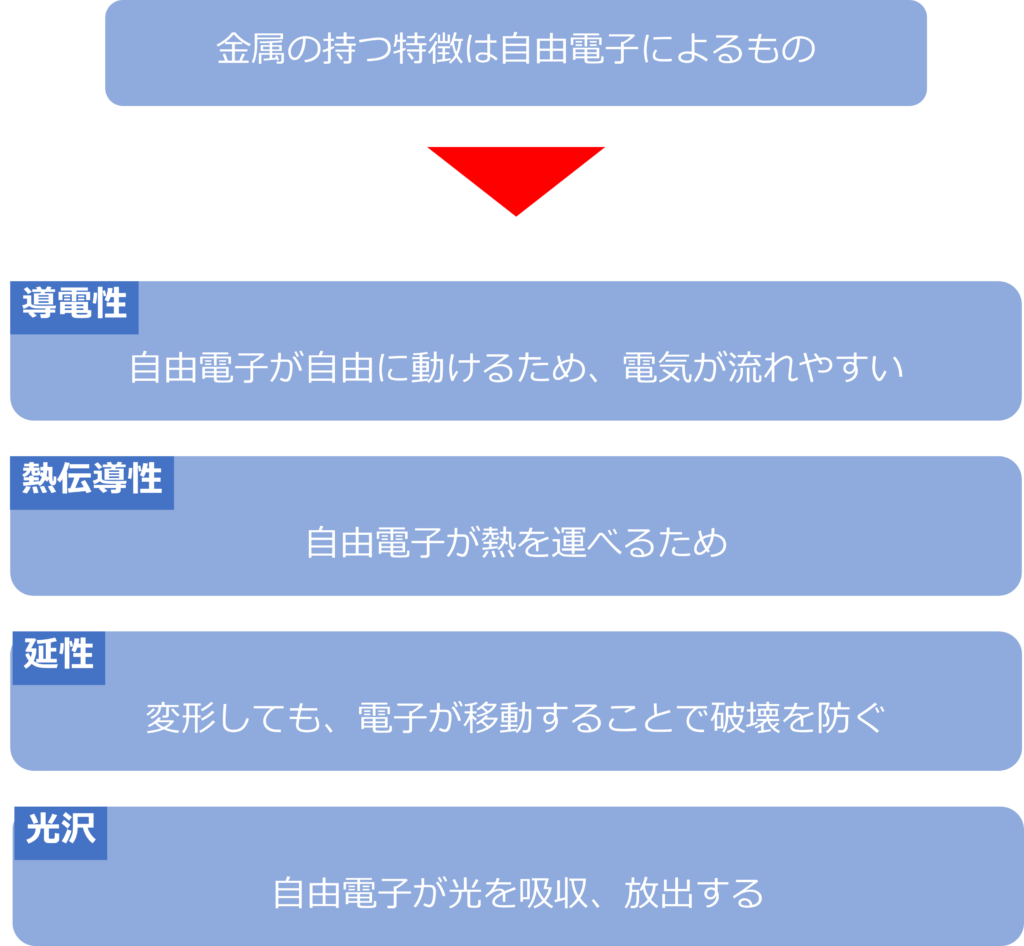
自由電子はどんな働きをしているのか
自由電子は金属特有の多くの特徴の要因となっています。
電気が流れたときには、自由電子が自由に動くことができるため、電気が流れやすく、高い電気伝導性をもっています。
自由電子は熱も運ぶことができるため、優れた熱伝導率を持ち、変形した際にも原子の移動に合わせて原子が移動することで破壊されることなく形を変えるため延性にも優れています。
また、自由電子は光を吸収した時に光を放出するため、金属はそれぞれ特有に光沢外観を持っています。


コメント