この本や記事で分かること
・酸、塩基とは何か
・どんな物質が酸や塩基になるのか
酸、塩基とは何か
リトマス試験紙に溶液を付けたときの色が青から赤に変化するものが酸、赤から青に変わるものをアルカリと学んだことを覚えている人も多いと思います。
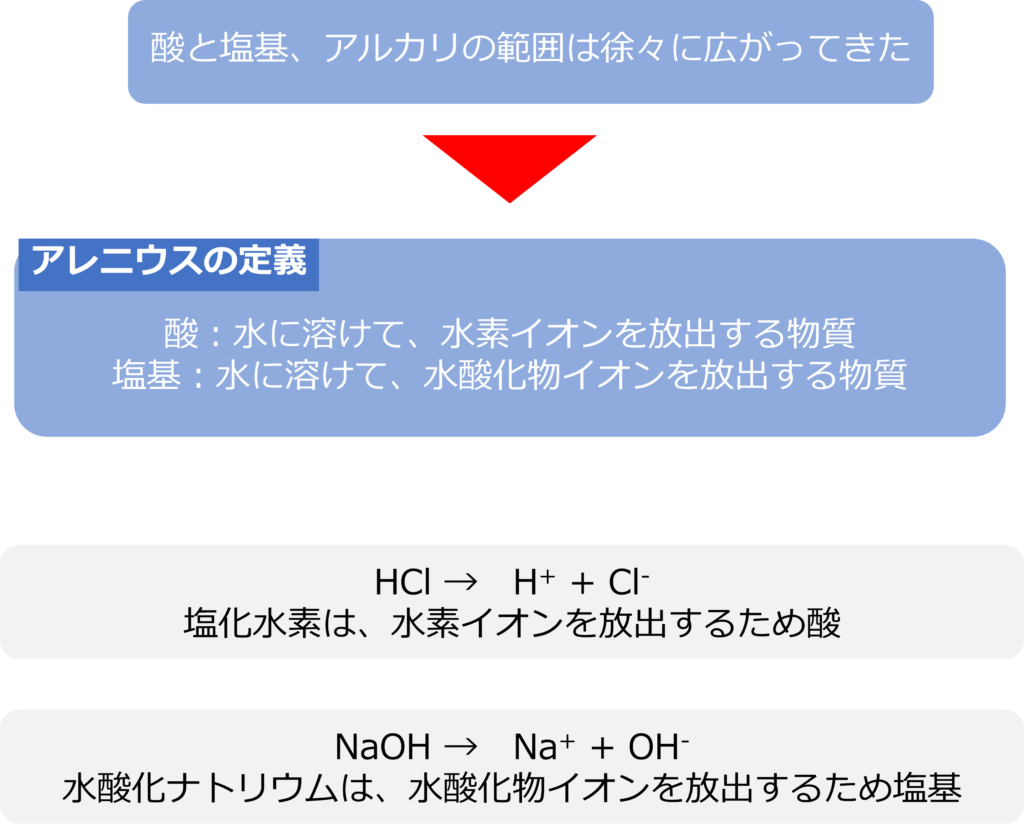
酸と塩基、アルカリは多くの定義があり、その範囲は徐々に広がってきました。
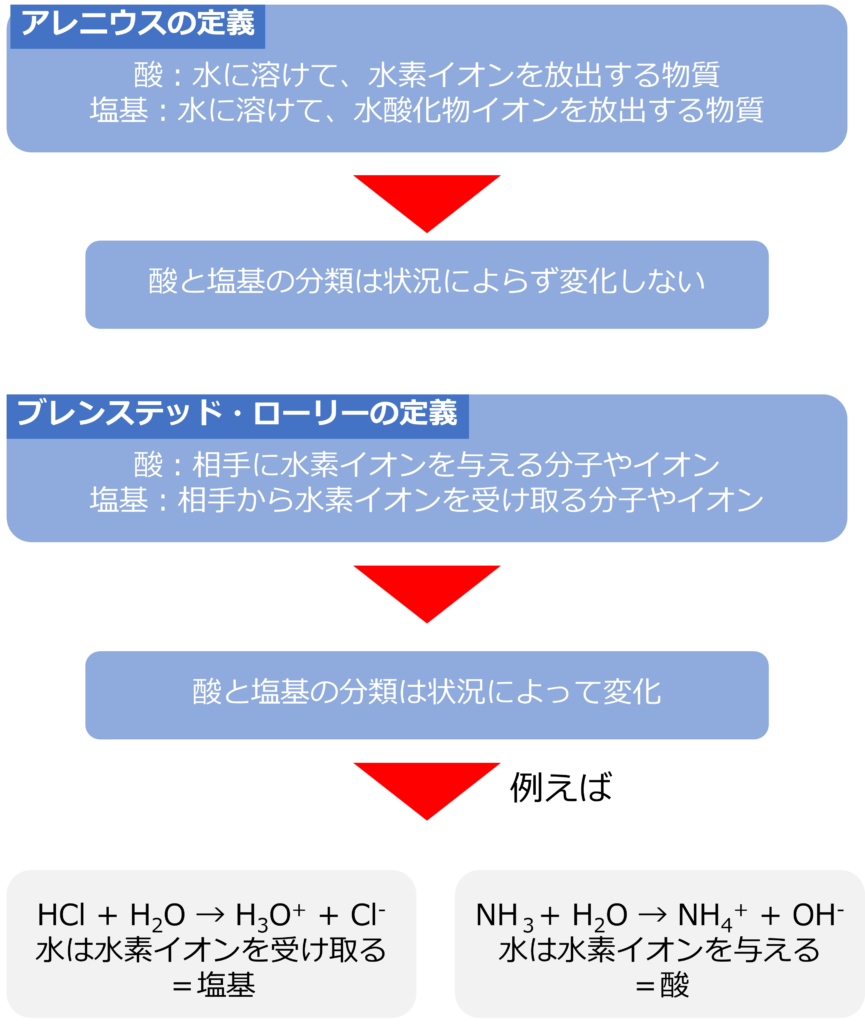
アレニウスは酸を「水に溶けて、水素イオンを放出する物質」、塩基を「水に溶けて、水酸化物イオンを放出する物質と定義しました。
塩化水素(HCl)は水に溶けると水素イオンと塩化物イオンに分かれるため、酸となり、水酸化ナトリウムは(NaOH)は塩基となります。
中和反応とは何か
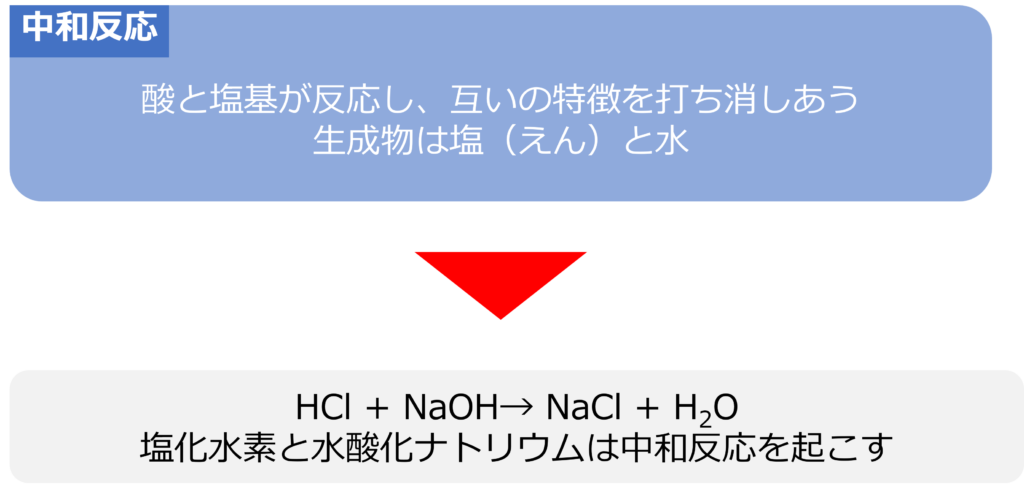
中和反応は酸と塩基が反応し、塩(えん)と水が生成する反応です。
塩化水素と水酸化ナトリウムが反応すると塩化ナトリウムと水が生成します。
HCl + NaOH → NaCl +H2O
酸と塩基が互いの特徴を打ち消し合うため、中和反応と呼ばれ、英語でも中立を意味するneutralizationが使用されています。
アンモニアは水酸化物イオンを含まないのに、なぜ塩基性なのか
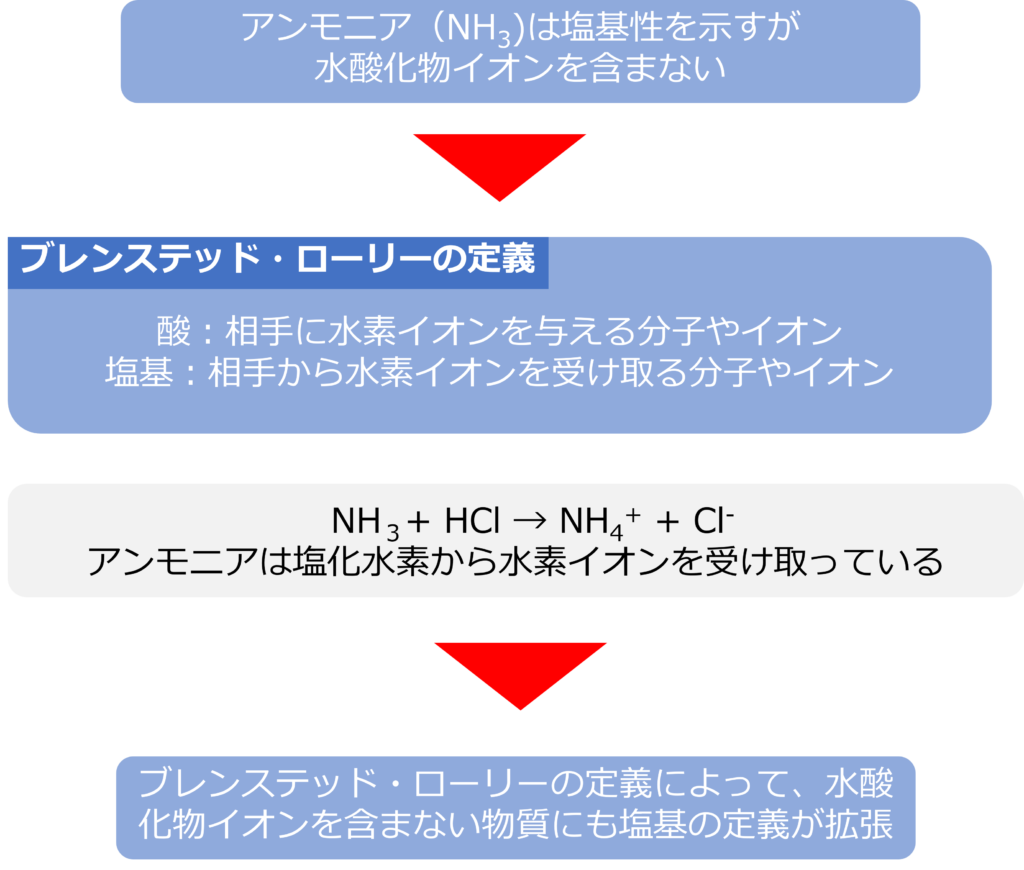
アンモニア(NH3)の水溶液は塩基性を示しますが、アンモニアには水酸化物イオンは含まれていません。
ブレンステッドとローリーはアレニウスの酸塩基の解釈を広げ、以下のように定義しました。
酸:相手に水素イオンを与える分子やイオン
塩基:相手から水素イオンを受け取る分子やイオン
アンモニアが塩化水素と反応するときを考えると
NH3+ HCl → NH4+ + Cl–
となり、塩化水素から水素イオンを受け取るアンモニアも塩基と定義されます。
ブレンステッド・ローリーの定義によって、水酸化物イオンを含まない物質にも塩基の定義が拡張されています。
水素イオンは水中でどのような形で存在しているのか
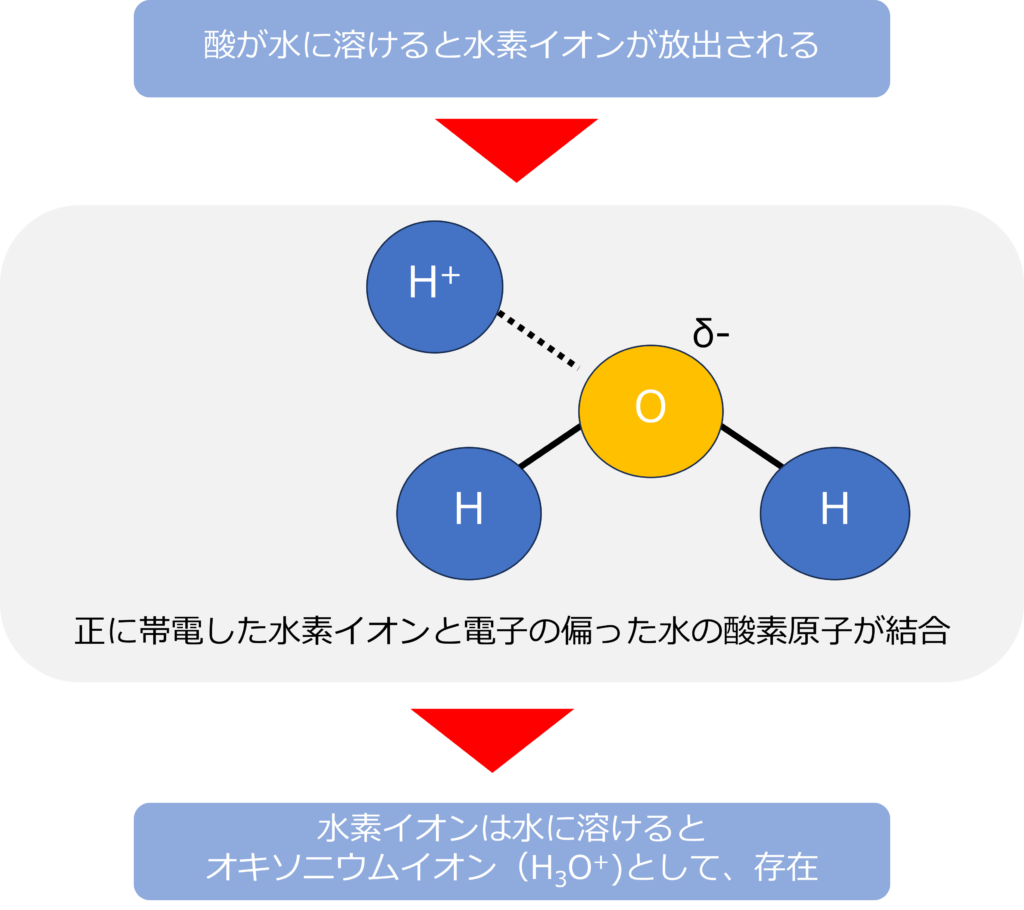
酸が水に溶けると水素イオン(H+)を放出しますが、電子を放出した水素イオンは1個の陽子からなりたっているため、とても小さな状態です。
水素原子の大きさと比較して、水素イオンの大きさはおよそ1/10,000ほどであり、非常に小さくなっています。
ごく小さな陽子は正に帯電しており、表面積に対してかなり巨大な電気量を持っている状態となります。
一方で、水には極性があり、酸素原子はわずかに-の電荷をもっています。そのため、水素イオンが水中に存在していると強く引き付けられて、オキソニウムイオン(H3O+)として、存在することとなります。
塩化水素が水に溶ける際には
HCl → H+ + Cl–
と簡易的に書かれていますが、実際には水素イオンそのものではなく、オキソニウムイオンとして存在しているため正確には以下のような記述が正しくなります。
HCl + H2O → H3O+ + Cl–
ただし、pHや中和反応ではH+のままであっても計算結果に差異が出ないことも多いため、簡略化した形で書かれる場合も少なくありません。
物質は常に酸や塩基のどちらかに分類されるのか
アレニウスの定義では、酸か塩基に分類された物質は、どんな状況でも変化することはありません。
一方で、ブレンステッド・ローリーの定義では反応の相手によって酸と塩基が変化することがあります。
塩化水素が水に溶ける反応は以下の通りです。
HCl + H2O → H3O+ + Cl–
この場合、水は水素イオンを受け取っているため、塩基となります。
一方で、アンモニアが水に溶ける反応は以下の通りです。
NH3+ H2O → NH4+ + OH–
この場合、水は水素イオンを与えているため、酸として働いています。
水素イオンや水酸化物イオンの有無ではなく、水素イオンの受け渡しに着目したことがブレンステッド・ローリーの定義の特徴であり、同じ物質でも状況によって酸と塩基が変化することもあります。
酸や塩基の価数とは何か
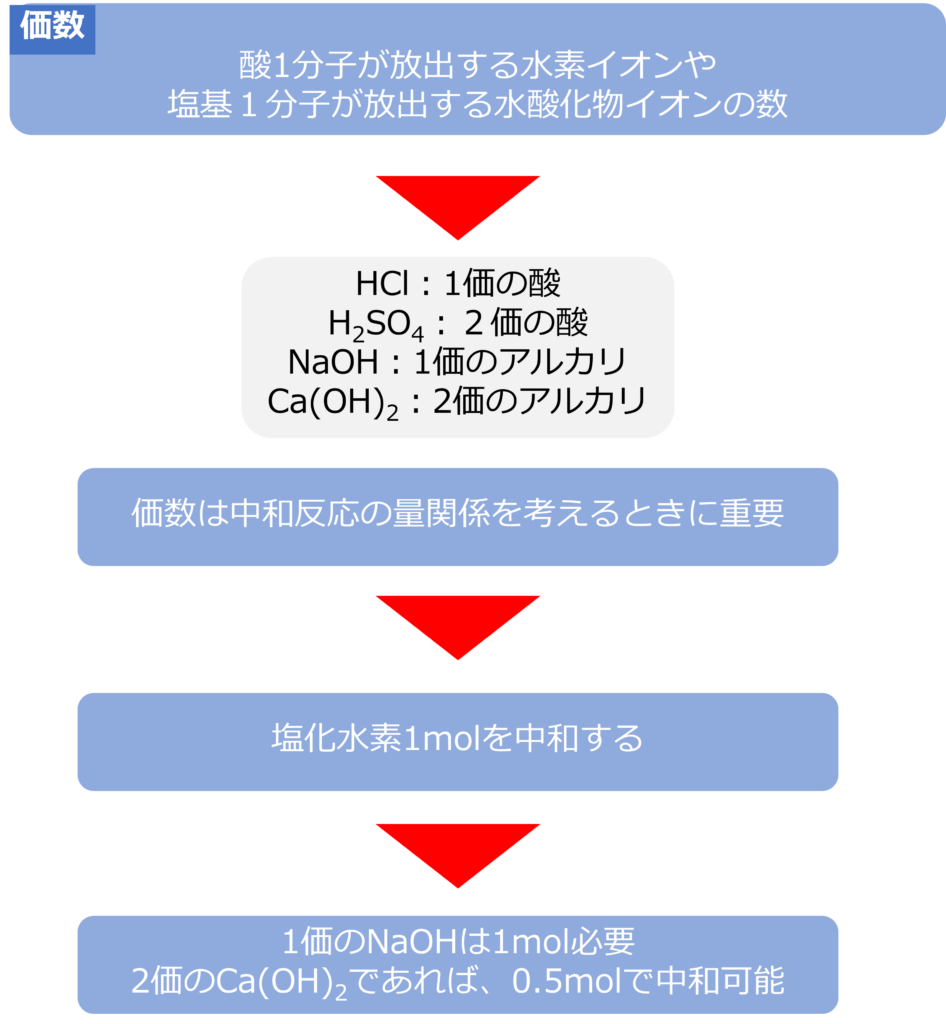
酸1分子から放出できる水素イオンや塩基1分子から放出できる水酸化物イオンの数は価数と呼びます。
塩化水素(HCl)は水素イオンと1個放出するため、1価の酸、水酸化ナトリウム(NaOH)は水酸化物イオンを1個放出するため、1価の塩基となります。
硫酸(H2SO4)は水素イオンと2個放出するため、2価の酸、水酸化カルシウム(Ca(OH)2)は水酸化物イオンを2個含むため2価の塩基となります。
価数は中和反応の際にどのような量で中和反応が進行するのかを考えるために重要です。
塩化水素1molを中和するには水酸化ナトリウムは1mol必要ですが、2価の塩基である水酸化カルシウムであれば、0.5molで中和することが可能です。


コメント