この本や記事で分かること
・酸の強さの表しかた
・pHとはなにか
水が電離するとどのような状態になっているのか
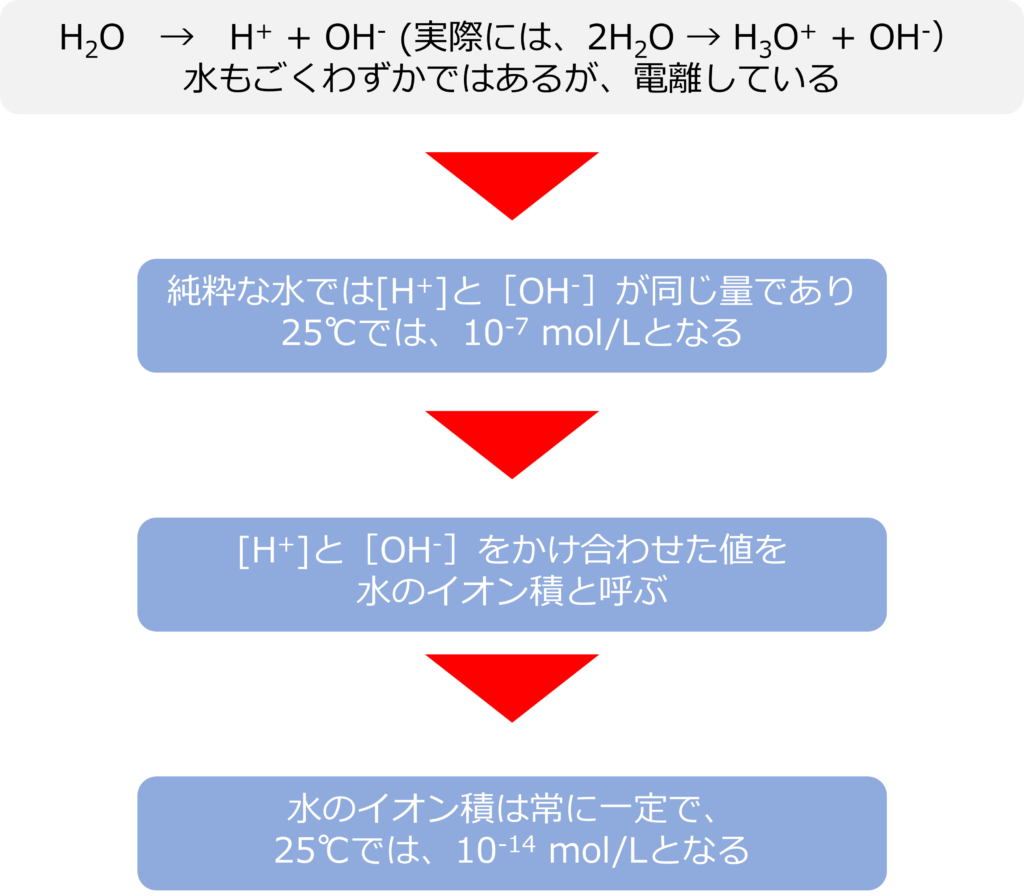
水もごくわずかに電離しており、次の様な状態で存在しています。
H2O → H+ + OH– (実際には、2H2O → H3O+ + OH–)
純粋な水では、H+ と OH– のモル濃度[mol/L]は同じ量になり、[H+]と[OH–]が25℃では、
10-7 mol/Lとなります。*[A]はAのモル濃度(mol/L)を示します。
[H+]と[OH–]かけ合わせた数値を水のイオン積と呼び、イオン積は温度が一定のとき、常に一定となり、25℃では10-14 mol/Lとなります。
水のイオン積は酸や塩基が溶けていても変化することはありません。
pHとは何か
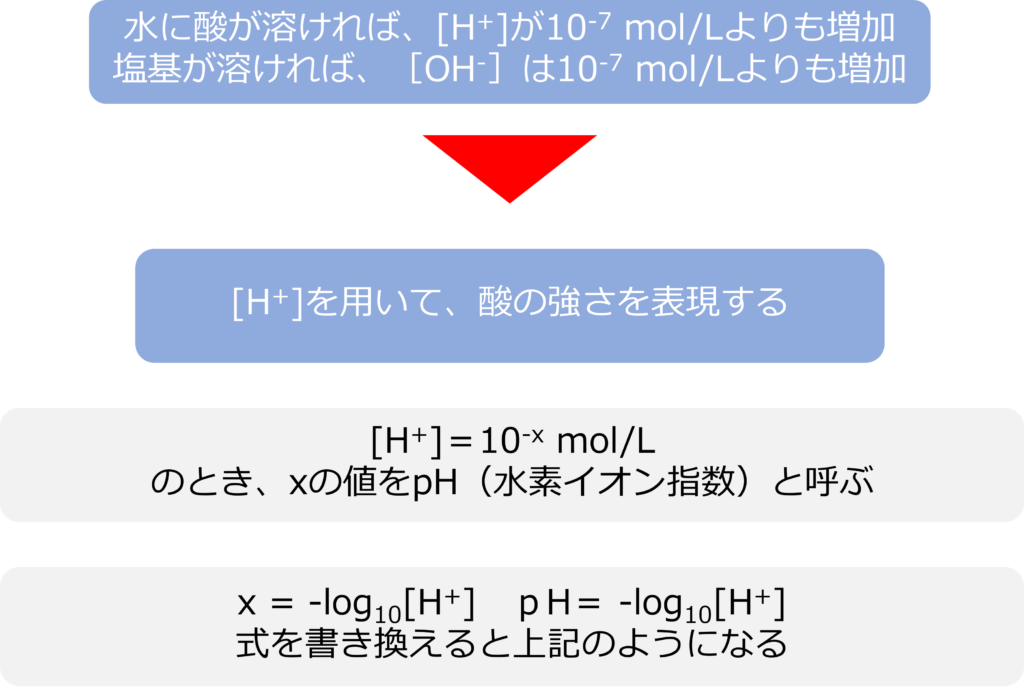
水に酸が溶けると、[H+]が10-7 mol/Lよりも増加し、水溶液は酸性に、塩基が溶けると[OH–]は10-7 mol/Lよりも増加し、水溶液は塩基性になります。
水のイオン積は酸や塩基が溶けても、変化しないため、[H+]が増加すれば、[OH–]は減少し、[OH–]が増加すれば、[H+]は減少します。
水素イオン濃度は幅広く変化するため、指数を用いて表されます。
[H+]=10-x mol/L
のとき、xの値をpH(水素イオン指数)と呼びます。上の式は
x = -log10[H+]
と書き換えることができ、
pH= -log10[H+]となります。
[H+]=10-2 mol/Lの溶液はpHが2、[H+]=10-11 mol/Lの溶液はpHが11となります。中性の水の[H+]=10-7 mol/LでpHは7になります。
酸の価数はpHにどのように影響するのか
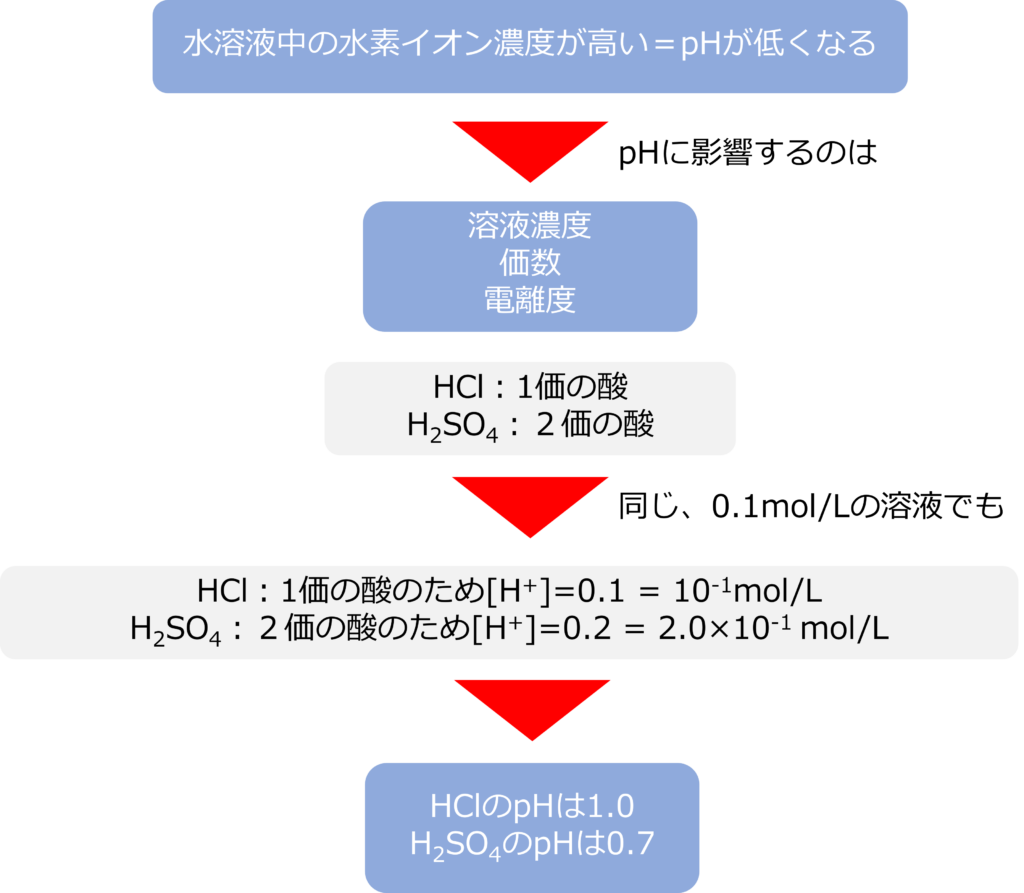
溶液中の水素イオン濃度が高い=pHが低くなります。
水素イオン濃度は溶液のモル濃度が高いほど、高くなりますが、それ以外にも価数や電離度も影響があります。
塩酸(HCl)と硫酸(H2SO4)を比較すると、それぞれが水溶液に溶けると
HCl → H+ + Cl–
H2SO4 → 2H+ + SO4–
となります。一価の酸である塩酸と比較し、二価の酸である硫酸の水素イオン濃度は倍になるため、同じ濃度の溶液の場合、硫酸のほうがpHは低くなります。
濃度が0.1mol/Lの場合、塩酸は[H+]=0.1 = 10-1 となるため、pHは1.0、硫酸は[H+]=0.2 = 2.0×10-1となるためpHは0.7となります。(log10 0.2 ≒ 0.7)
電離度とは何か、pHにどのように影響するのか
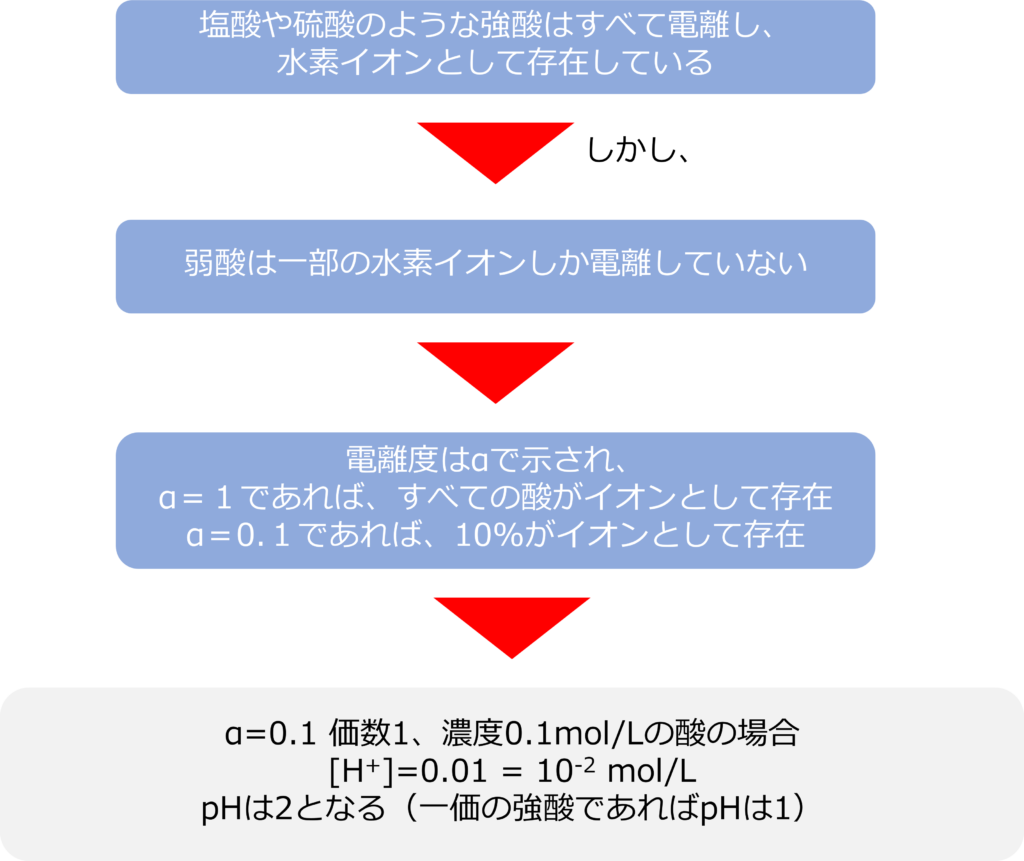
価数以外に電離度もpHに影響を与えます。硫酸や塩酸のような強酸は、溶液中で全て水素イオンとして存在しています。
しかし、酢酸やシュウ酸のように一部の水素イオンしか電離していない酸も存在しています。
電離度αは溶けている酸や塩基のうち、どれくらいが電離し、イオンとして存在してるかを示しています。
α=1であれば、すべての酸や塩基はイオンとして存在しており、このような酸は強酸、塩基は強塩基と呼ばれます。
α=0.1であれば、酸や塩基の内、10%しかイオンになっていないことを示します。一価の酸の電離度が0.1で、濃度が0.1mol/Lの場合
[H+]=0.01 = 10-2
となり、pHは2となります。電離度の低い酸は弱酸、塩基は弱塩基と呼ばれ、強酸と比較するとお暗示濃度であっても、pHは低くなります。
塩の性質はなにで決まるのか
中和反応で生成する塩(えん)の性質は反応物である酸と塩基の性質によって決まります。
一般的に、塩の水溶液の性質は以下のようになります。
・強酸 + 強塩基:塩は水に溶けて、中性
・強酸 + 弱塩基:塩は水に溶けて、酸性
・弱酸 + 強塩基:塩は水に溶けて、塩基性
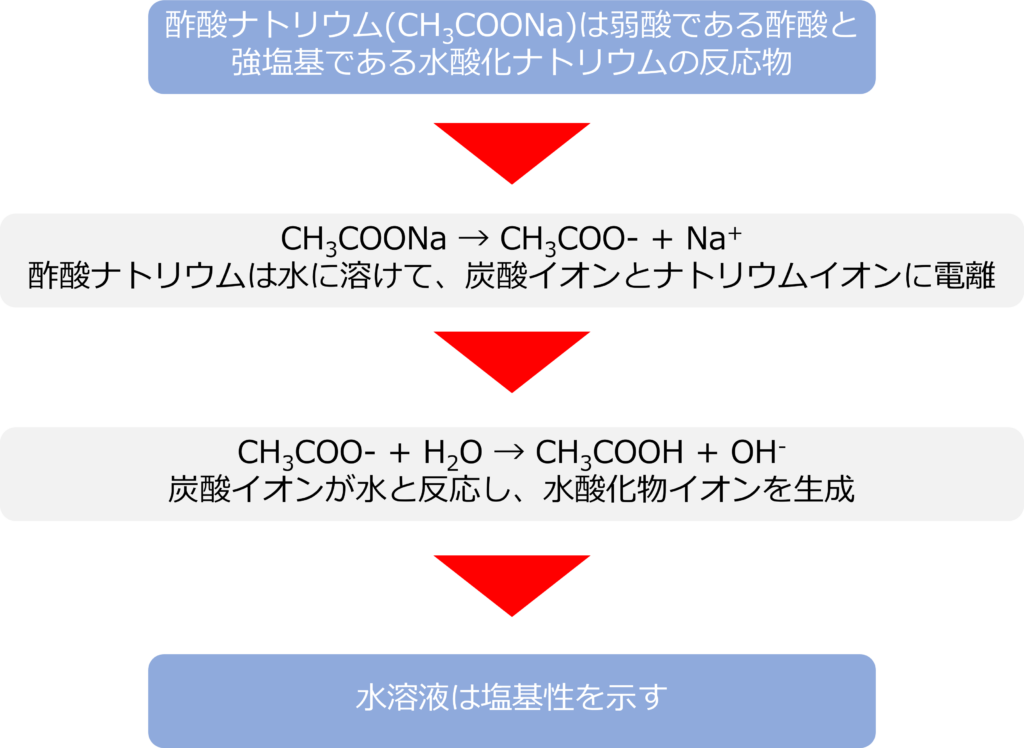
酢酸ナトリウムを水に溶かすとどうなるのか
酢酸ナトリウム(CH3COONa)は弱酸である酢酸と強塩基である水酸化ナトリウムの反応物であるため、水に溶けると塩基性となります。
酢酸ナトリウム(CH3COONa)は水に溶けると炭酸イオンとナトリウムイオンに電離します。
CH3COONa → CH3COO- + Na+
発生した酢酸イオンは水と反応し水酸化物イオンを生成します。
CH3COO- + H2O → CH3COOH + OH–
ナトリウムイオンは水と反応することはないため、水溶液は塩基性を示します。水と反応するのは炭酸イオンや炭酸水素イオンのような弱酸が電離することで生じる陰イオンのみであるため、弱酸と強塩基の化合物は塩基性を示します。
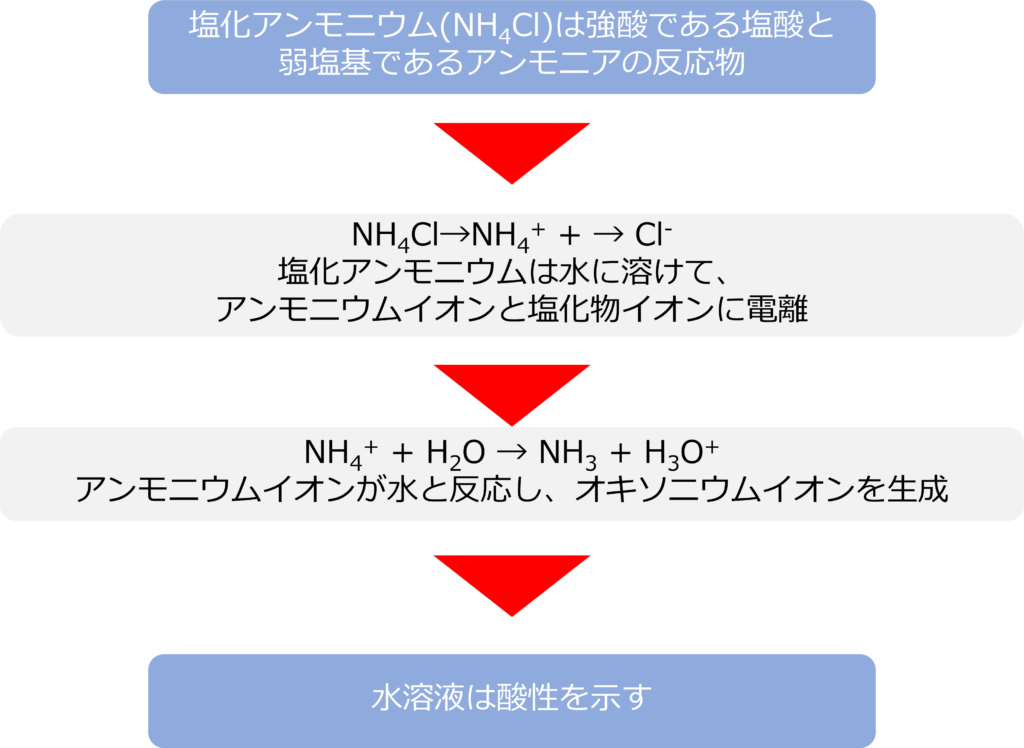
塩化アンモニウムを水に溶かすとどうなるのか
強酸である塩酸と弱塩基であるアンモニアの生成物である塩化アンモニウム(NH4Cl)は水にけるとアンモニウムイオンと塩化物イオンに電離します。
NH4Cl→NH4+ + → Cl–
生成したアンモニウムイオンが水と反応し、オキソニウムイオンを生じます。
NH4+ + H2O → NH3 + H3O+
塩化物イオンは水と反応すことはないため、水溶液は酸性を示します。


コメント