この本や記事で分かること
・ルイスはどのように酸と塩基を定義したのか
・ルイス酸にはどんなものがあるのか
ルイスの酸、塩基の定義とはどのようものか
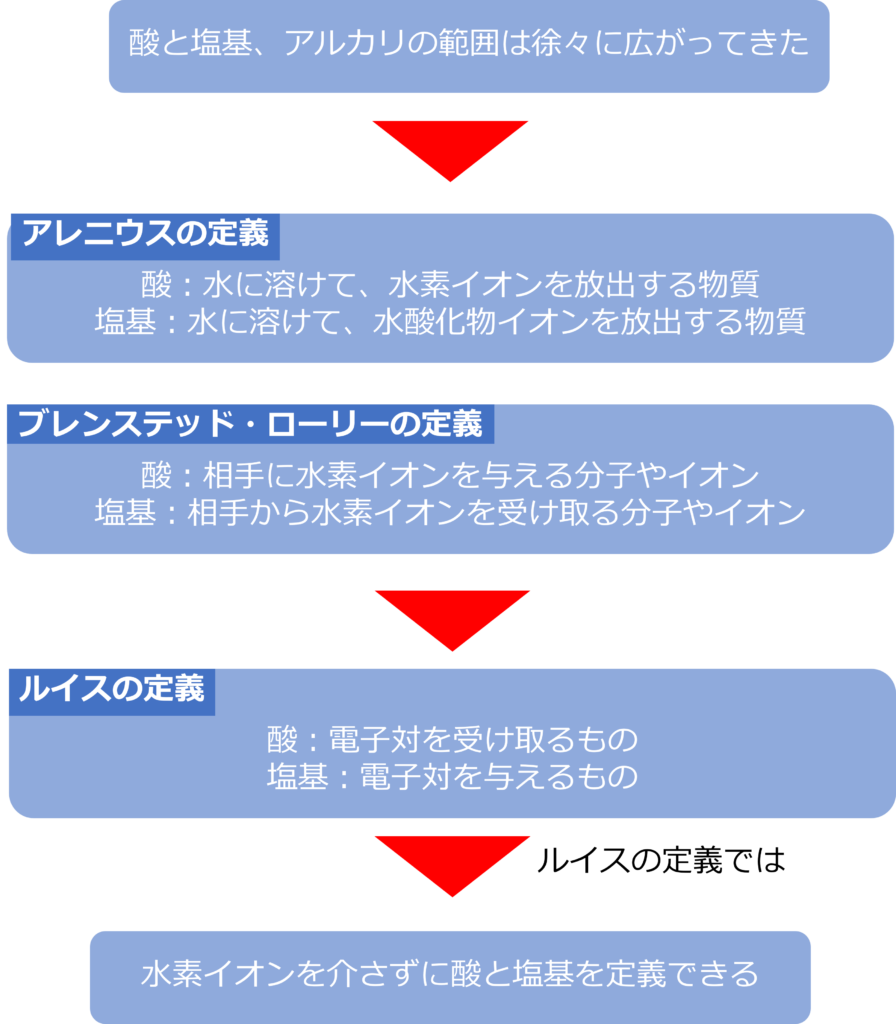
アレニウスは酸を「水に溶けて、水素イオンを放出する物質」、塩基を「水に溶けて、水酸化物イオンを放出する物質と定義しました。
その後、ブレンステッドとローリーはアレニウスの酸塩基の解釈を広げ、酸を「相手に水素イオンを与える分子やイオン」、塩基を「相手から水素イオンを受け取る分子やイオン」と定義しました。
ルイスは酸と塩基の定義をさらに広げ、酸と塩基を電子対の受け渡しという面から定義しています。
ルイスは酸を「電子対を受け取るもの」、塩基を「電子対を与えるもの」と定義しました。
電子対の受け渡しを定義にすることによって、水素イオンを介すことなく、酸と塩基を定義することが可能になりました。
アンモニアをルイスの定義で捉えるとどうなるのか
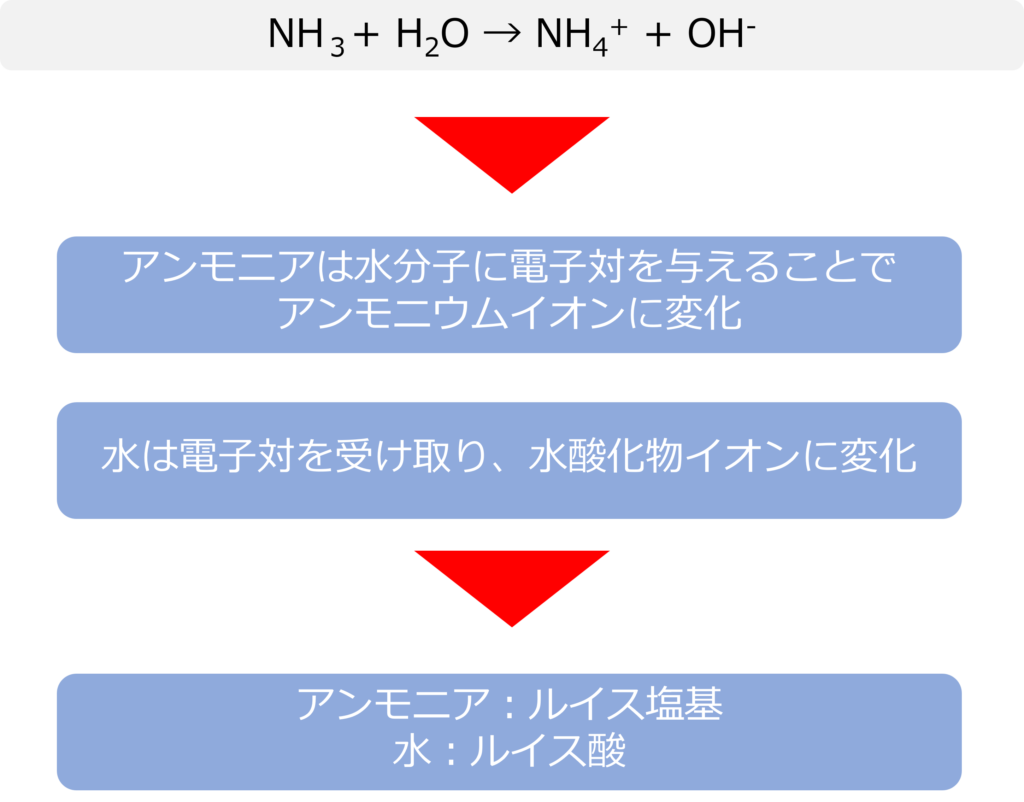
アンモニアが水に溶けると以下のような反応を起こします。
NH3+ H2O → NH4+ + OH–
この反応をルイスの定義から見ると、アンモニア(NH3)は水分子の水素に電子対を与えることで、アンモニウムイオンへと変化しています。
電子対を与えるアンモニアがルイス塩基、電子対を受け取る側の水がルイス酸であるということができます。
水素イオンを含まない酸や塩基にはどんなものがあるのか
アンモニアが水に溶ける反応は、ブレンステッドとローリーの定義でも酸と塩基の定義が可能です。
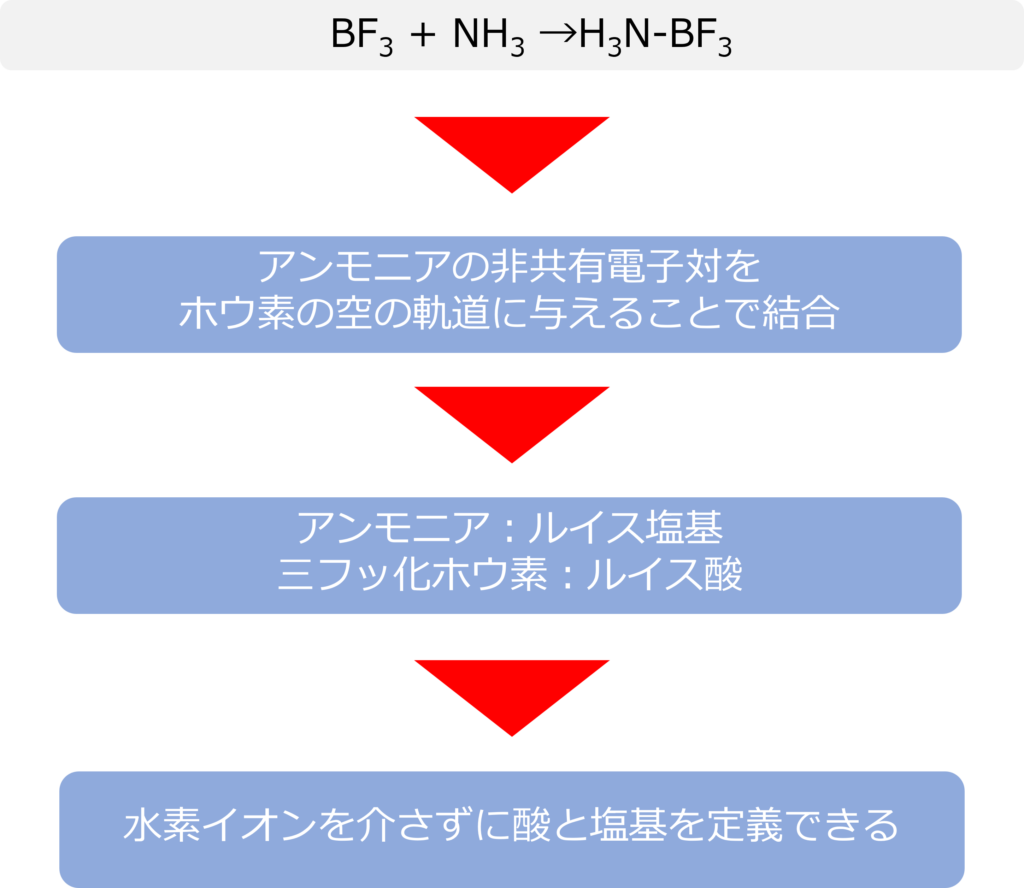
三フッ化ホウ素とアンモニアは以下のような反応を示します。
BF3 + NH3 →H3N-BF3
ホウ素は価電子3つもっており、フッ素と結合していますが、共有された電子の数は6個になっているため、あと2つ電子を取り入れることでより安定になります。
そのため、アンモニアが非共有電子対をホウ素に電子対を与えることで、結合を形成しています。電子対を与えるアンモニアは塩基に、電子対を受け取る三フッ化ホウ素が酸に分類可能です。
ルイス酸の定義では、水素イオンを含まない化合物でも酸、塩基の定義が可能になります。
錯体を酸や塩基で定義するとどうなるのか
金属と非金属の化合物は錯体と呼ばれています。
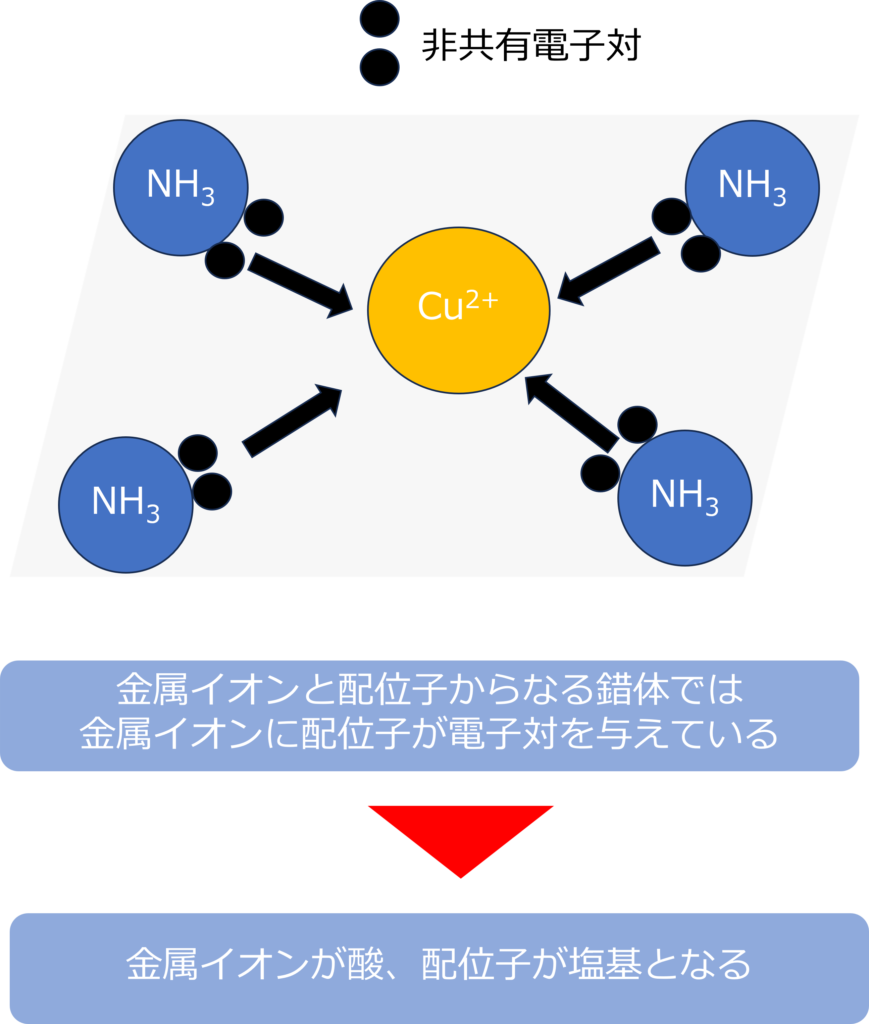
錯体の中でも、金属イオンと配位子と呼ばれる非金属原子が配位結合と呼ばれる結合を形成して、イオンとなっている物質は錯イオンと呼ばれます。
錯イオンでは、配位子が電子対を与え、もう片方の物質である金属が電子対を受け取るため、配位子が塩基、金属が酸となります。
テトラアンミン銅(Ⅱ)イオン[Cu(NH3)4]2+であれば、銅はアンミン配位子から電子対を受けとっておいるため、酸、アンミン配位子が塩基となります。


コメント