この本や記事で分かること
・酸化還元反応にはどんなものがあるのか
・半反応式とは何か
・半反応式から酸化還元反応を作成するにはどうすれば良いのか
酸化剤、還元剤にはどのようなものがあるのか
電子の放出と授受である酸化還元反応は様々な酸化剤と還元剤が反応することで発生します。
酸化剤は電子を奪いやすい性質をもつ物質であり、オゾン(O3)、硝酸(HNO3)、熱濃硫酸(H2SO4)、過マンガン酸カリウム(KMnO4)、二クロム酸カリウム(K2Cr2O7))などがあげられます。
還元剤は電子を失い、イオン化しやすい物質でナトリウム(Na)、カリウム(K)、亜鉛(Zn)、鉄Ⅱ塩、シュウ酸((COOH)2)などがあります。
硝酸や硫酸はどのような反応式で酸化剤として働くのか
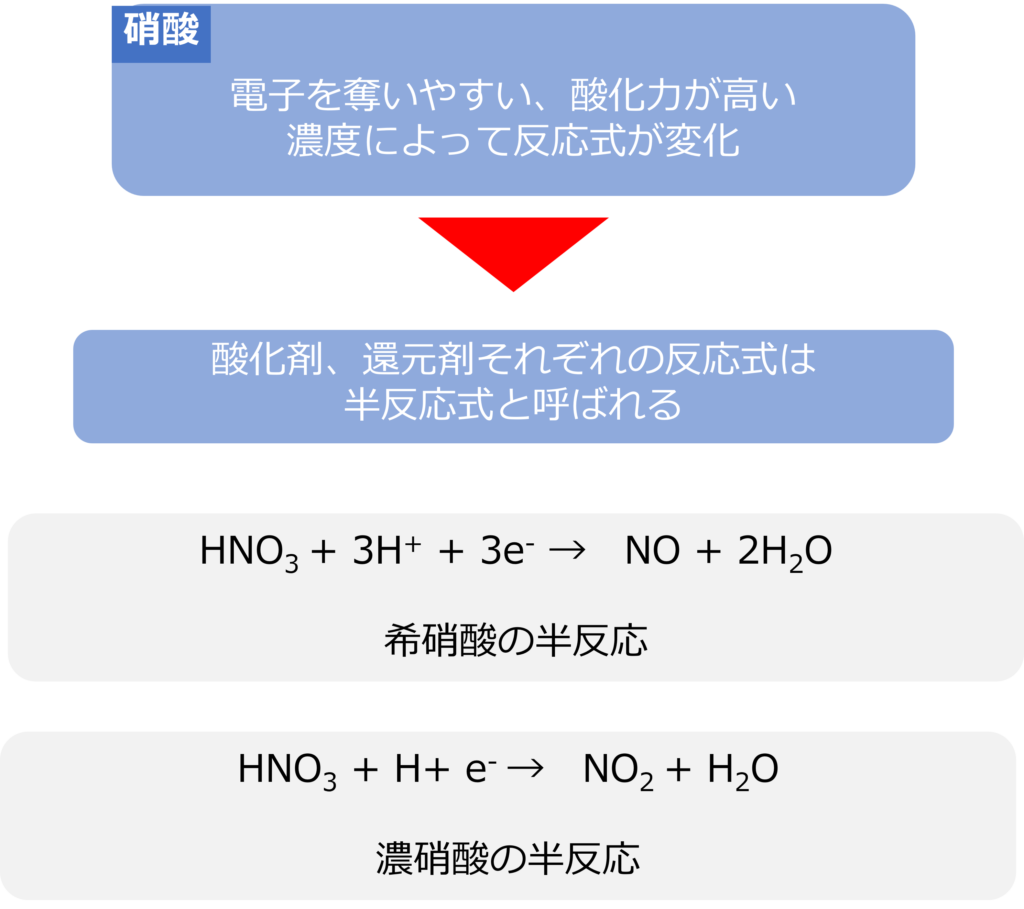
硝酸は酸化力が高く、電子を奪い自身は還元されやすい物質です。硝酸は濃度によって反応式が以下のように変化します。
希硝酸であれば、
HNO3 + 3H+ + 3e– → NO + 2H2O
濃硝酸であれば、
HNO3 + H+ e– → NO2 + H2O
となります。
硫酸は温度が高く、濃度が濃い状態で酸化剤として働きます。
H2SO4 + 2H+ + 2e– → SO2 + 2H2O
実際の酸化還元反応は酸化反応と還元反応がセットで起きるため、酸化剤、還元剤それぞれの反応は半反応式と呼ばれます。
半反応式はどのように作ることができるのか
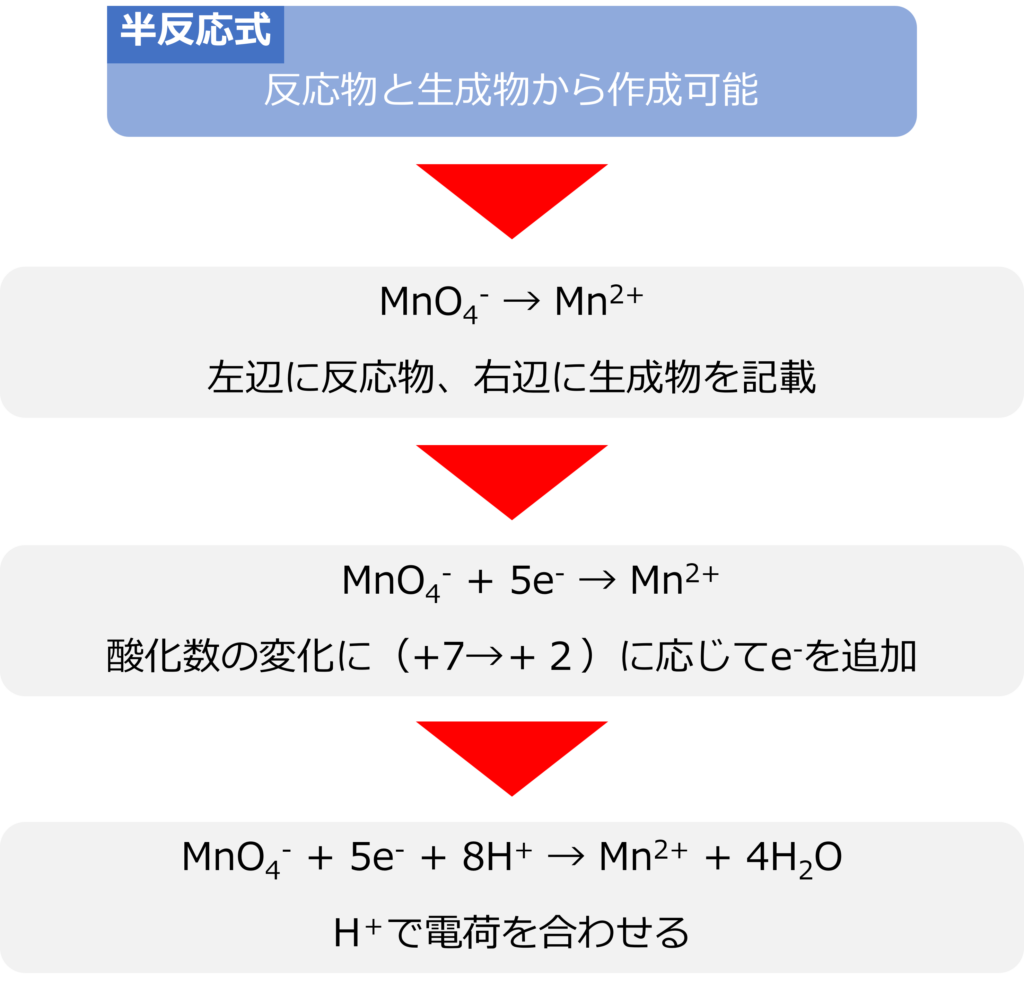
半反応式は反応物と生成物が分かれば、作り出すことが可能です。まずは左辺に反応物を、右辺に生成物を記載します。
過マンガン酸カリウム(KMnO4)であれば、左辺にMnO4–を右辺にMn2+を記載します。
MnO4– → Mn2+
次に、酸化数の変化に合わせてe–を加えます。過マンガン酸カリウムであれば左辺のMnの酸価数は+7、Mn2+は+2となります。そのため左辺に5e–を加えます。
MnO4– + 5e– → Mn2+
酸化数の変化を合わせた後は全体の電荷を合わせるために、H+を加えます。上記式の場合は左辺の電荷が‐6、右辺が+2であるため、左辺に8H+を記載します。
MnO4– + 5e– + 8H+ +→ Mn2+
最後に、水分子を加えて、全体の原子数を合わせます。上記式の場合は右辺に4H2Oを記載します。
MnO4– + 5e– + 8H+ → Mn2+ + 4H2O
還元剤の半反応式はどのように作るのか
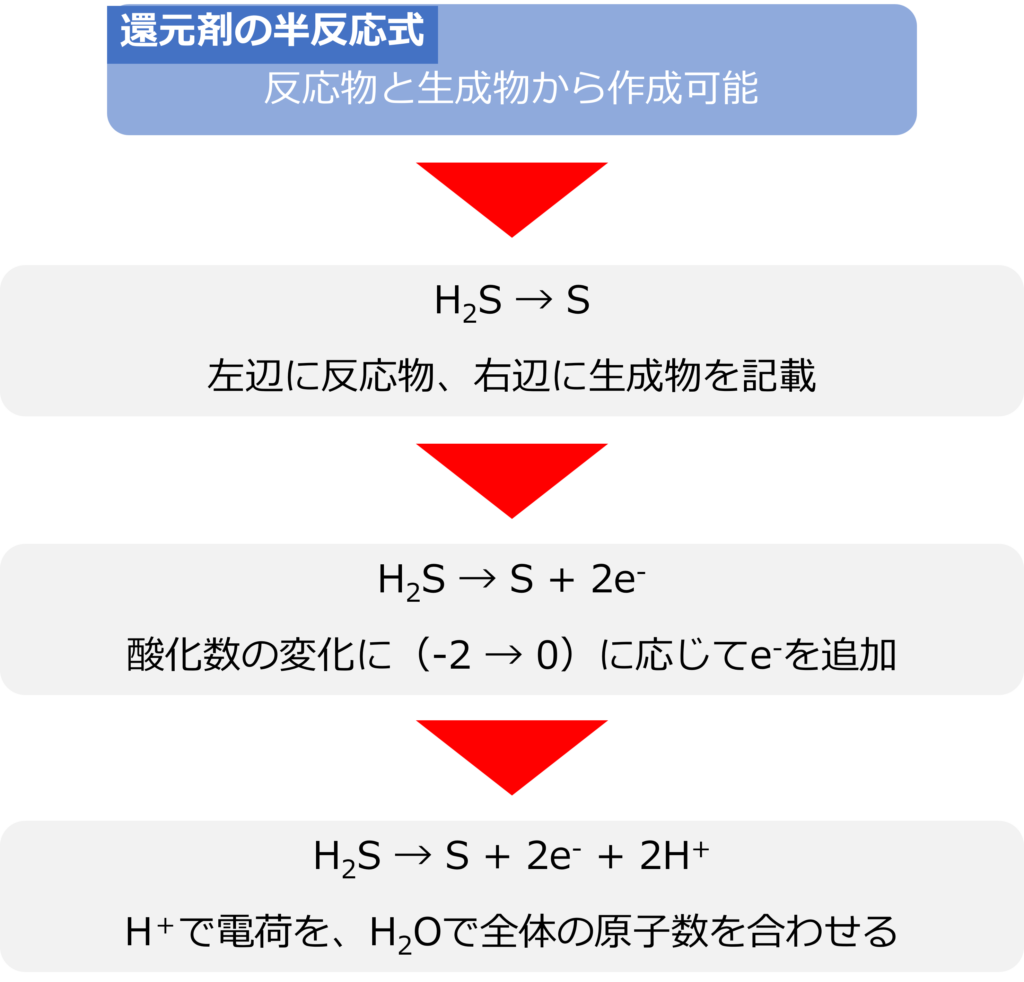
還元剤であっても、半反応式の作り方は同様です。硫化水素(H2S)であれば、反応物はH2S、生成物はSとなります。
H2S → S
硫化水素の硫黄の酸化数は‐2、右辺の硫黄の酸価数は0となるため、左辺に2個の電子を追加します。
H2S → S + 2e–
さらに、右辺に2個の水素イオンを追加し、電荷を合わせます。
H2S → S + 2e– + 2H+
硫化水素では酸素がふくまれないため、水分子で全体の原子数を合わせる必要はありません。
半反応式から実際の酸化還元反応式を作るにはどうすれば良いのか
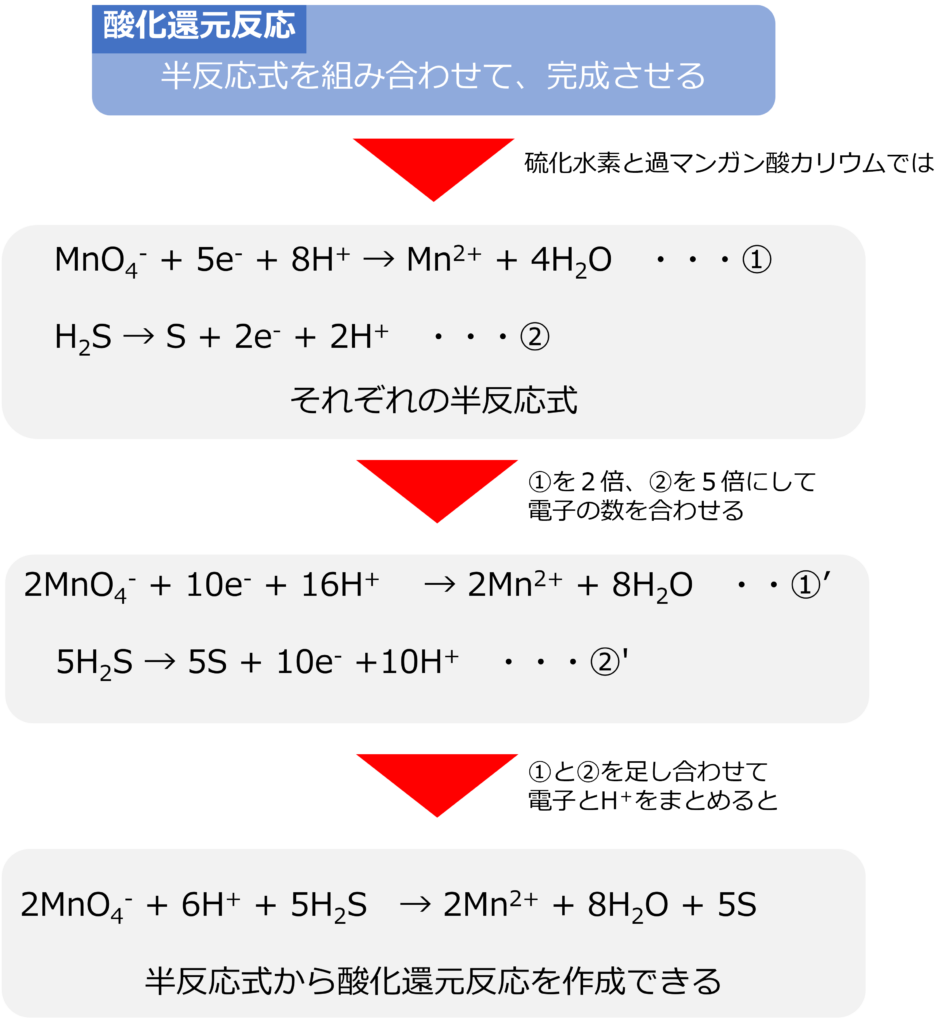
半反応式同士を組み合わせることで、酸化還元反応を完成させることが可能です。硫酸酸性中の硫化水素と過マンガン酸カリウムを反応では、それぞれの半反応式は以下のようになります。
MnO4– + 5e– + 8H+ → Mn2+ + 4H2O ・・・①
H2S → S + 2e– + 2H+ ・・・②
電子の数を合わせるために、①の式の係数をすべて2倍に、②の式を5倍にします。
2MnO4– + 10e– + 16H+ → 2Mn2+ + 8H2O ・・・①’
5H2S → 5S + 10e– +10H+ ・・・②’
①’と②’を足し合わせます。
2MnO4– + 10e– + 16H+ + 5H2S → 2Mn2+ + 8H2O + 5S + 10e– +10H+
電子と水素イオンをまとめると
2MnO4– + 6H+ + 5H2S → 2Mn2+ + 8H2O + 5S
となります。半反応式の電子の数を合わせて、足し合わせて、両辺の電子の数を同じにして、消去することで、半反応式から酸化還元反応式を作り出すことができます。


コメント