この本や記事で分かること
・マンガン電池の構造、特徴
・アルカリ電池の構造、特徴
・電池の違いによる使い分け
マンガン電池とは何か
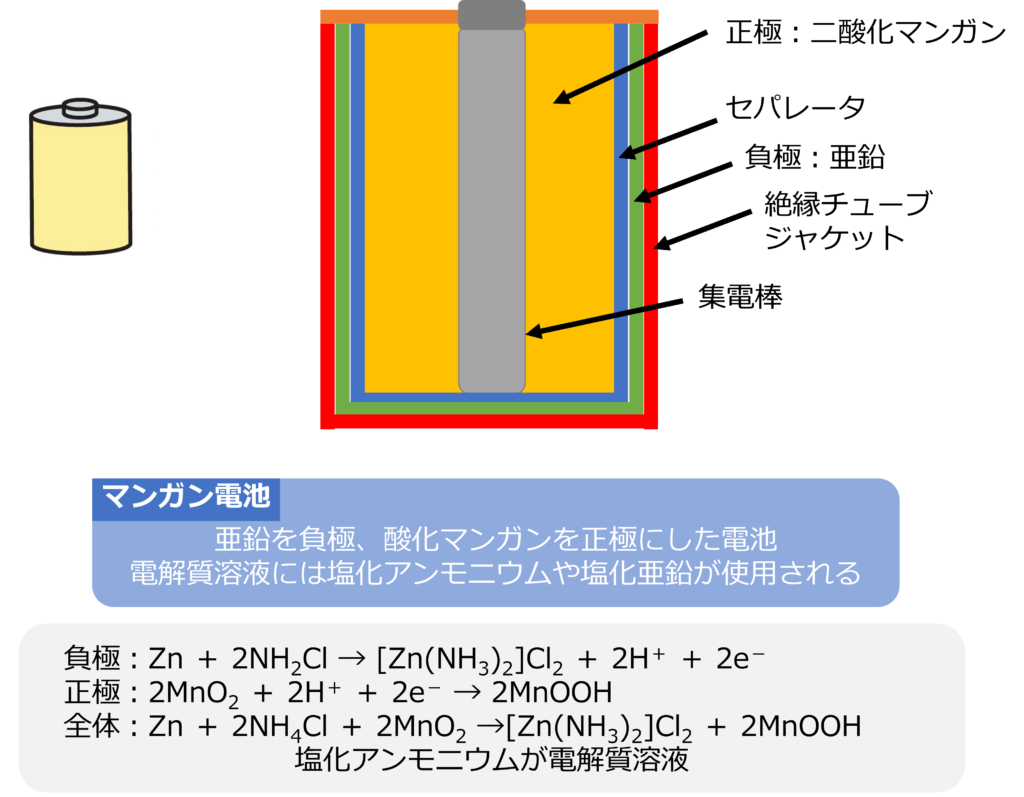
負極に亜鉛を、正極に酸化マンガンを利用した電池がマンガン電池です。
電解質溶液には、塩化アンモニウムや塩化亜鉛が使用されます。
電解液に塩化アンモニウムを用いた場合、反応式は以下のようになります。
負極:Zn + 2NH2Cl → [Zn(NH3)2]Cl2 + 2H+ + 2e-
正極:2MnO2 + 2H+ + 2e- → 2MnOOH
全体:Zn + 2NH4Cl + 2MnO2 →[Zn(NH3)2]Cl2 + 2MnOOH
マンガン電池はの利点は何か
多くの電解質を必要とする、ボルタ電池やダニエル電池は液体部分が多く、持ち運びにくいという欠点がありました。
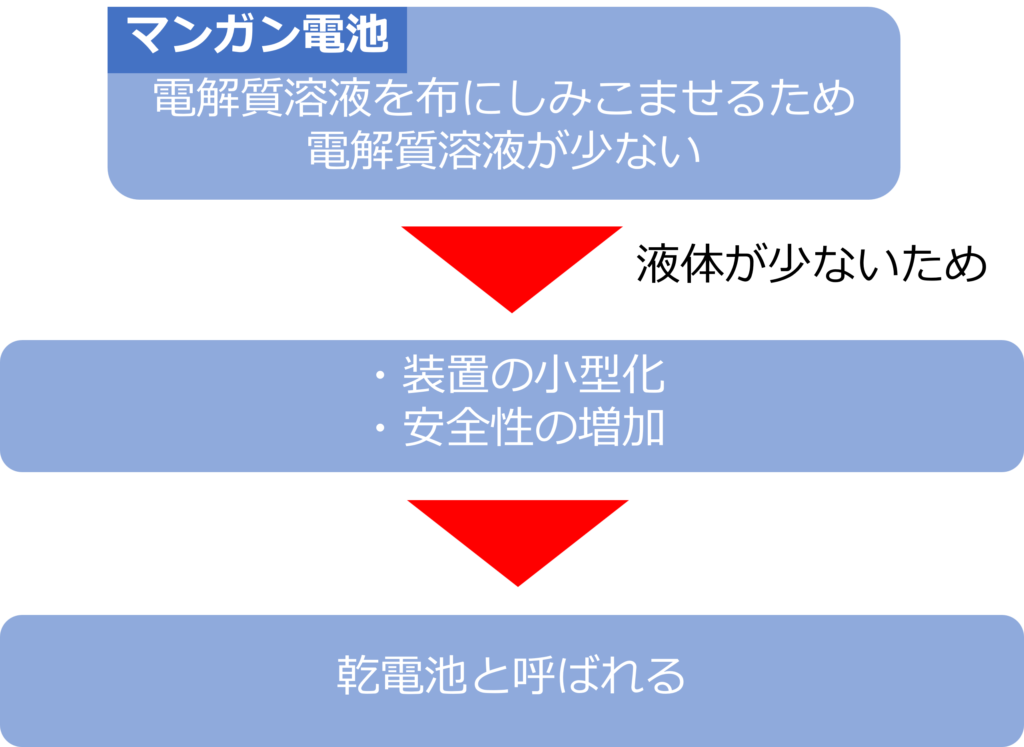
塩化アンモニウムを用いたマンガン電池では、電解質溶液である塩化アンモニウムを布などにしみこませて、巻き付けることで、電解質溶液の量を減らすことができています。
電解質溶液の減少は装置の小型化、危険性の大きな薬液を使用しないなどの多くの利点をもたらしています。
液体成分がないわけではありませんが、それ以前の電池と比較すると、液体の量が少ないため、乾電池と呼ばれています。
また、電池では、負極の電子と水素イオンが反応し、水素が発生することで、電流が流れにくくなる分極が問題となります。
二酸化マンガンはプロトンを酸化することで、分極を防ぐことができるため、電池として機能しやすくなっています。
このように分極を防ぐ物質を減極剤と呼びます。
液漏れを発生しにくくするにはどうすれば良いのか
塩化アンモニウムを電解質溶液として、利用すると水が生成する副反応が起きてしまいます。
2NH4Cl + OH- → NH3 + Cl– + H2O
発生した水が増加すると、液漏れが発生しやすくなってしまいます。
そこで、塩化亜鉛を電解質溶液に利用したマンガン電池も利用されています。
負極:4Zn + ZnCl2 + 8H2O →ZnCl2・4Zn(OH)2 + 8H+ + 8e-
正極:8MnO2 + 8H+ + 8e- → 8Mn(O)OH
全体:4Zn + ZnCl2 + 8H2O + 8MnO2 →ZnCl2・4Zn(OH)2 + 8Mn(O)OH
塩化亜鉛を使用することで、負極側で水が消費されるため、より液漏れが発生しにくくなっています。

マンガン電池の特徴は何か
マンガン電池は、中央部に集電剤として働く炭素棒があり、その周囲に正極である二酸化マンガンと電解液を混合したペーストをいれ、外側にセパレーターを挟んで、負極となる亜鉛が存在しています。
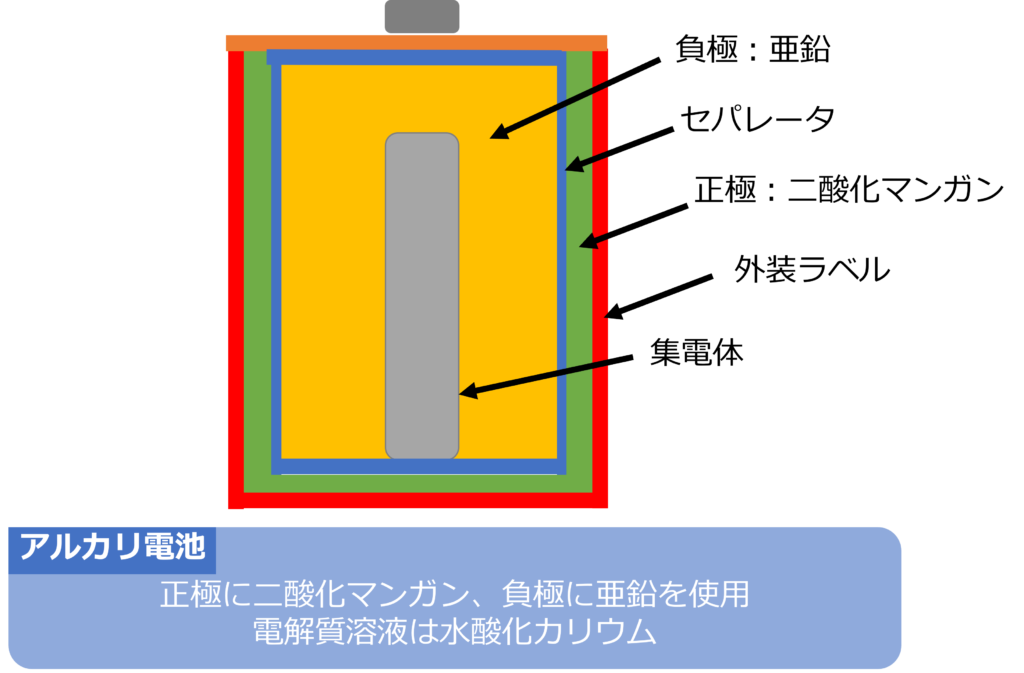
マンガン電池とは逆に中央部に集電剤である真鍮棒があり、その周囲に負極となる亜鉛粉末を、セパレーターを挟んで正極である二酸化マンガンを入れ、電解質溶液として水酸化カリウムを使用した電池もあります。
電解質溶液である水酸化カリウムは、負極となる亜鉛粉末と混ぜた状態になっています。
このような電池はアルカリ性である水酸化カリウムを使用しているため、アルカリ電池と呼ばれます。
アルカリ電池は電極でどのような反応をしているのか
アルカリ電池の正極と負極の反応は以下の通りです。
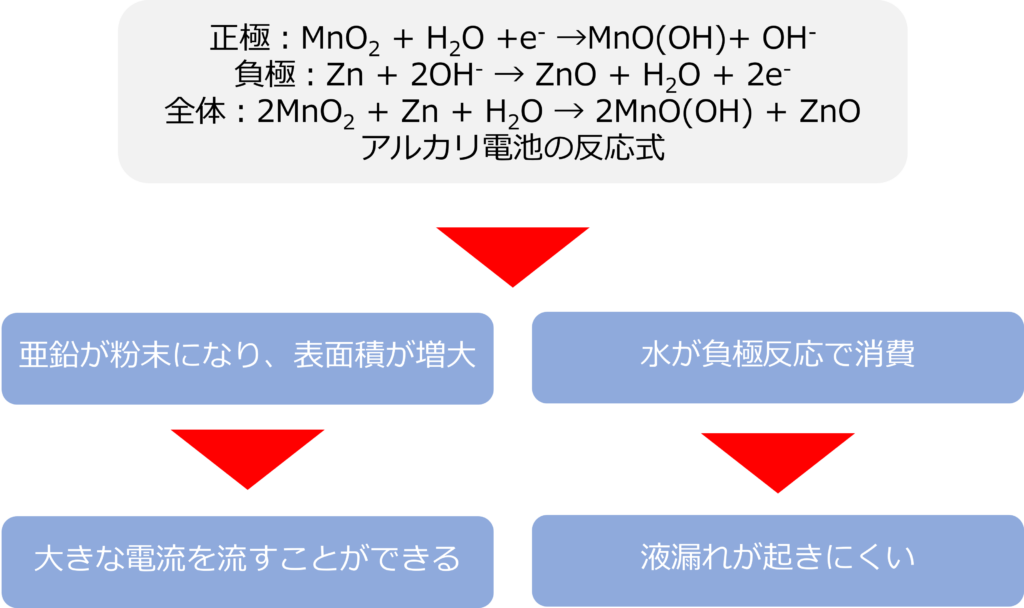
正極:MnO2 + H2O +e– →MnO(OH)+ OH–
負極:Zn + 2OH– → ZnO + H2O + 2e–
全体:2MnO2 + Zn + H2O → 2MnO(OH) + ZnO
負極の亜鉛を粉末状にしたことで、表面積が増大したため、マンガン電池と比較しても大きな電流を流すことができるようになっています。
また、水を反応で消費できるため、塩化亜鉛を電解質溶液として利用したマンガン電池と同じように、液漏れが発生しにくくなっています。
マンガン電池とアルカリ電池はどのように使い分けると良いか
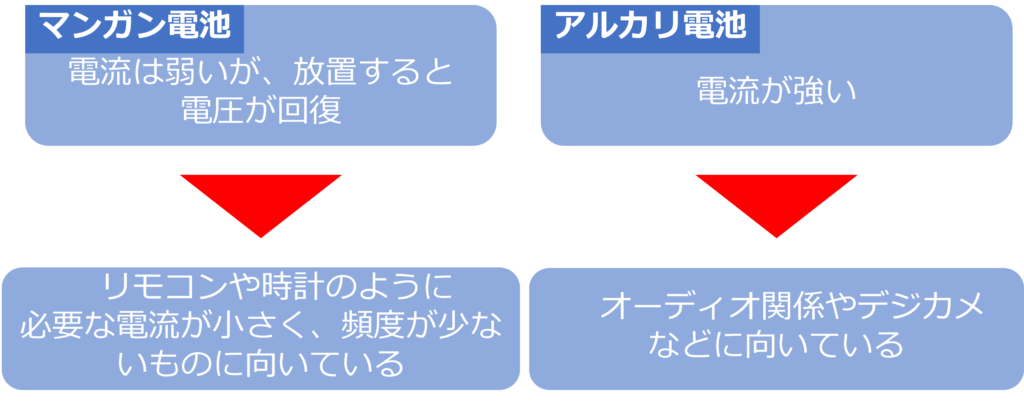
アルカリ電池は大きな電流を長い時間流すことが可能になっているため、大きな電流を流す必要のある機器に向いています。
オーディオ関係やデジカメ、ミニ四駆のような走るおもちゃなどにはアルカリ電池が向いています。
マンガン電池は、電流は弱いものの、電気を流さない状態でおいておくと、電圧が回復するという特徴があります。
電気が流れている状態では、反応に必要な物質が電極周囲で消費され、濃度が薄くなったり、反応の邪魔をする物質が増えることで、電圧が低下してしまいます。
電気を流さないで置いておくと、物質が拡散することで、電極周囲の反応物の濃度が高くなり、電圧が回復させることが可能です。
そのため、リモコンや時計のように必要な電流量が小さい、使用する頻度が少ないものには、マンガン電池が向いているといえます。


コメント