この本や記事で分かること
・酸化剤としても還元剤として働く物質の種類
・過酸化水素や二酸化硫黄の半反応式
・過酸化水素の酸素の酸化数が‐1の理由
酸化剤としても、還元剤としても働く物質にはどんなものがあるのか
酸化還元反応には、様々な物質が関わっており、硝酸や硫酸は酸化剤として、硫化水素などは還元剤として働きます。
一方で、反応する相手によって酸化剤になったり、還元剤になる物質も存在しています。
過酸化水素や二酸化硫黄は、条件によって、酸化剤として働くこともあれば、還元剤として働くこともある物質になっています。
過酸化水素が酸化剤として働くときの半反応式はどのようなものか
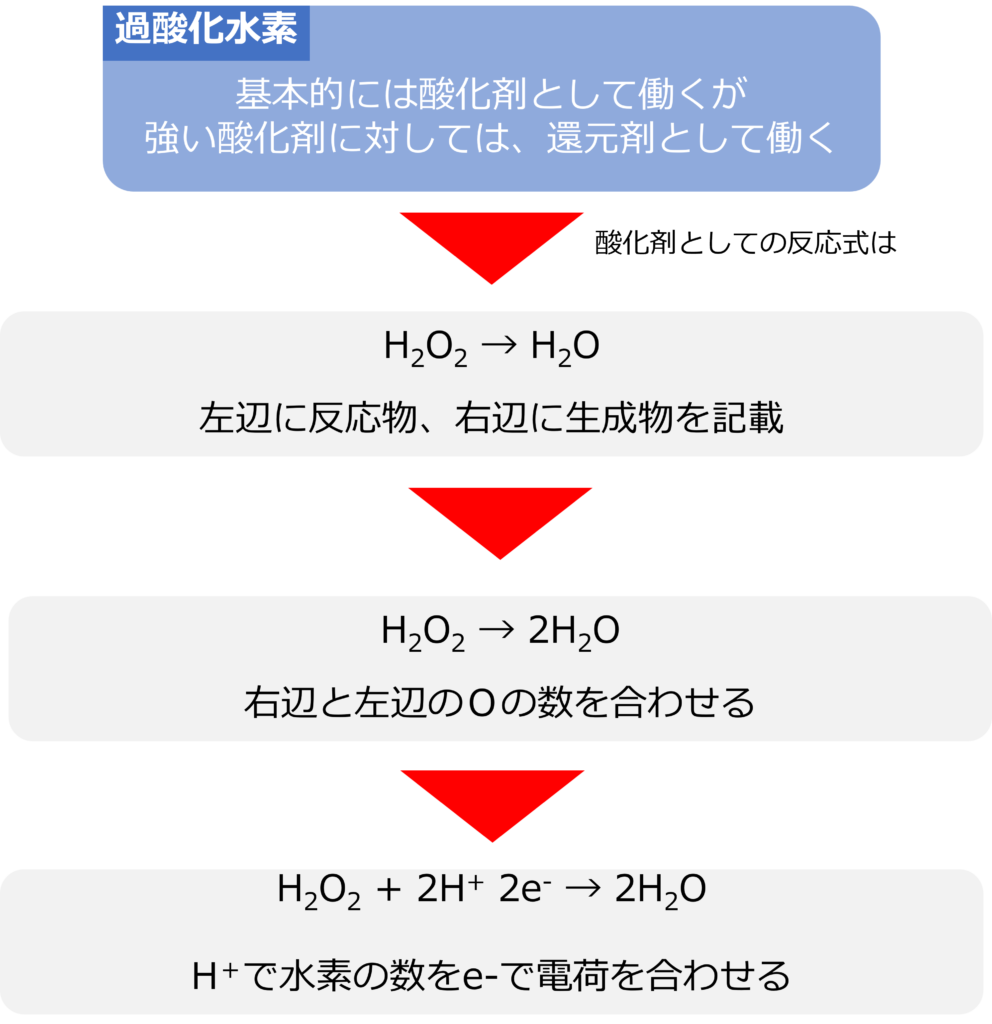
過酸化水素(H2O2)は基本的に、酸化剤として働きますが、強い酸化剤と反応させると、還元剤としても働きます。
酸化剤として働く際には過酸化水素は水へと変化します。
H2O2 → H2O
右辺と左辺のOの数を合わせます。
H2O2 → 2H2O
次に、水素の数を水素イオンで調整します。
H2O2 + 2H+→ 2H2O
最後に、電子の数を調整することで、半反応式を完成させることができます。
H2O2 + 2H+ 2e– → 2H2O
過酸化水素の酸素の酸化数はなぜ、-1なのか
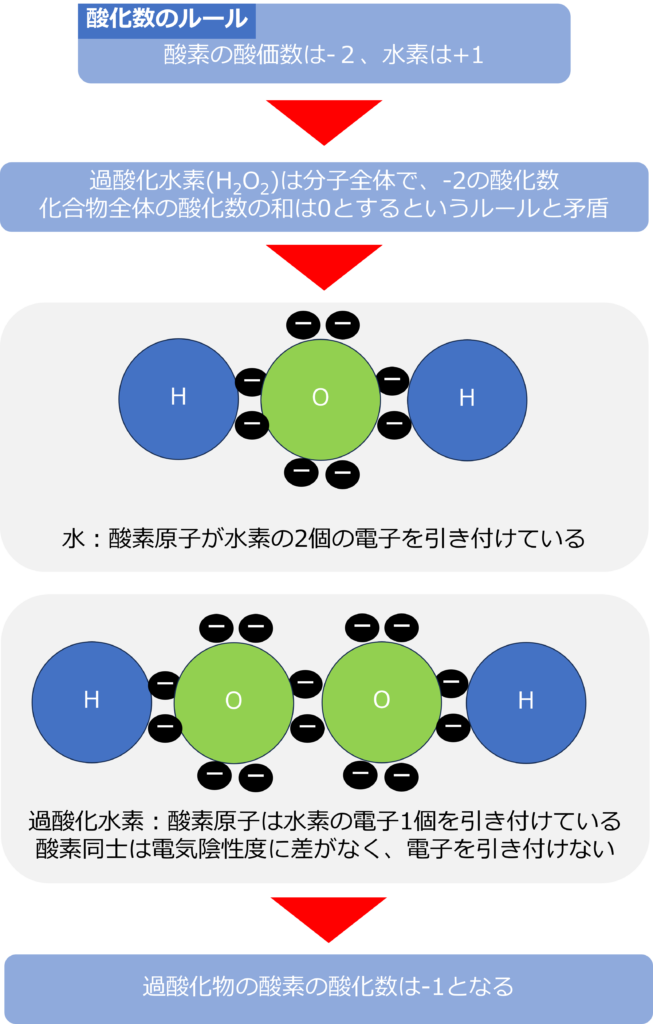
酸価数は、一般的に化合物中の酸素の酸価数は‐2、水素は+1と定められています。
上記の通り計算すると、過酸化水素(H2O2)は分子全体で、-2の酸化数となってしまい、化合物全体の酸化数の和は0とするというルールと矛盾してしまいます。
水分子の場合酸素は二つの水素と結合しており、水素の持つ電子をすべて引き付けていると考え、酸化数が‐2としていました。
過酸化水素の場合、酸素は水素ともう一つの酸素と結合しています。酸素同士では電気陰性度に差異がなく、電子を引き寄せているわけではありません。
そのため、酸素の酸価数は⁺1となります。過酸化水素のように酸素が二つ連なった化合物は過酸化物と呼ばれ、過酸化物の酸素の酸化数は+2ではなく、+1となります。
過酸化水素が還元剤として働くときの半反応式はどのようになるか
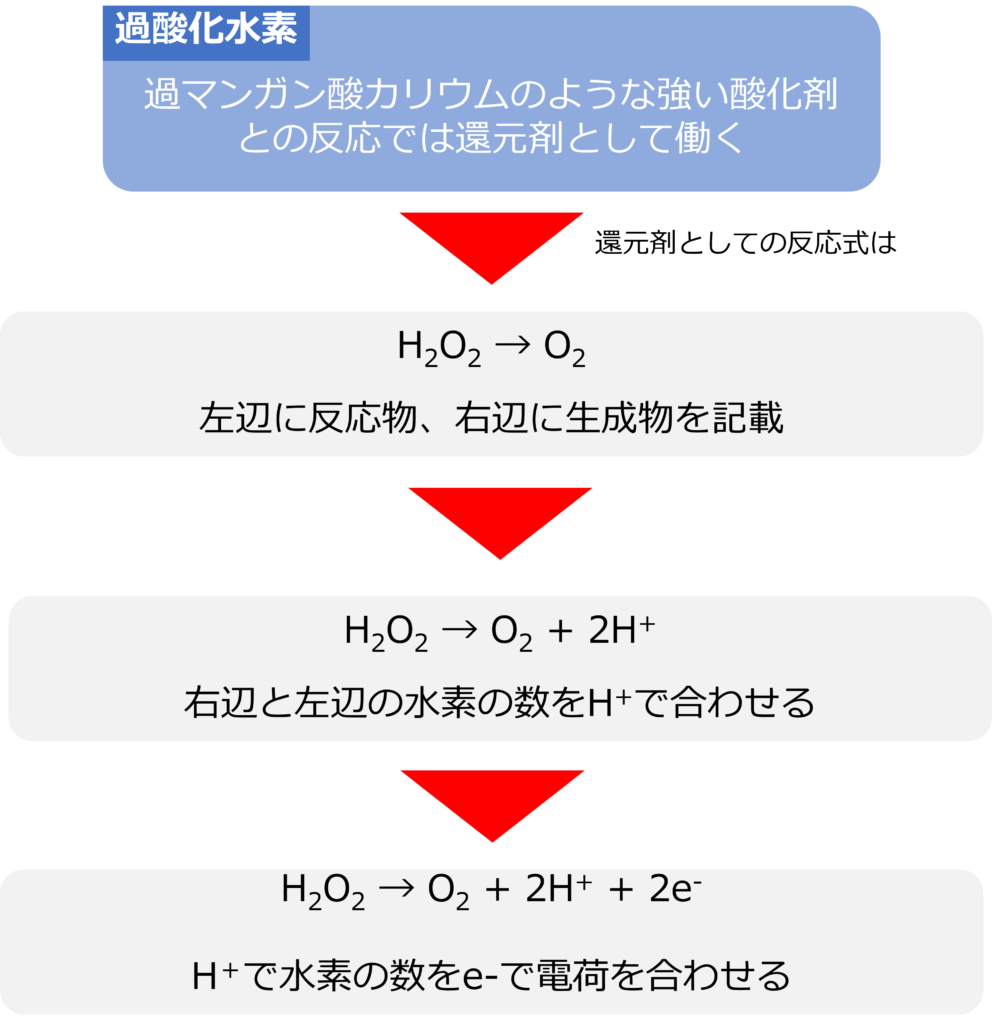
過酸化水素は過マンガン酸カリウムのような強い酸化剤が存在すると、還元剤としても働くことができます。
H2O2 → O2
水素の数を水素イオンで調整します。
H2O2 → O2 + 2H+
次に、電荷の数を電子で調整します。
H2O2 → O2 + 2H+ + 2e–
二酸化硫黄はどのような半反応式となるのか
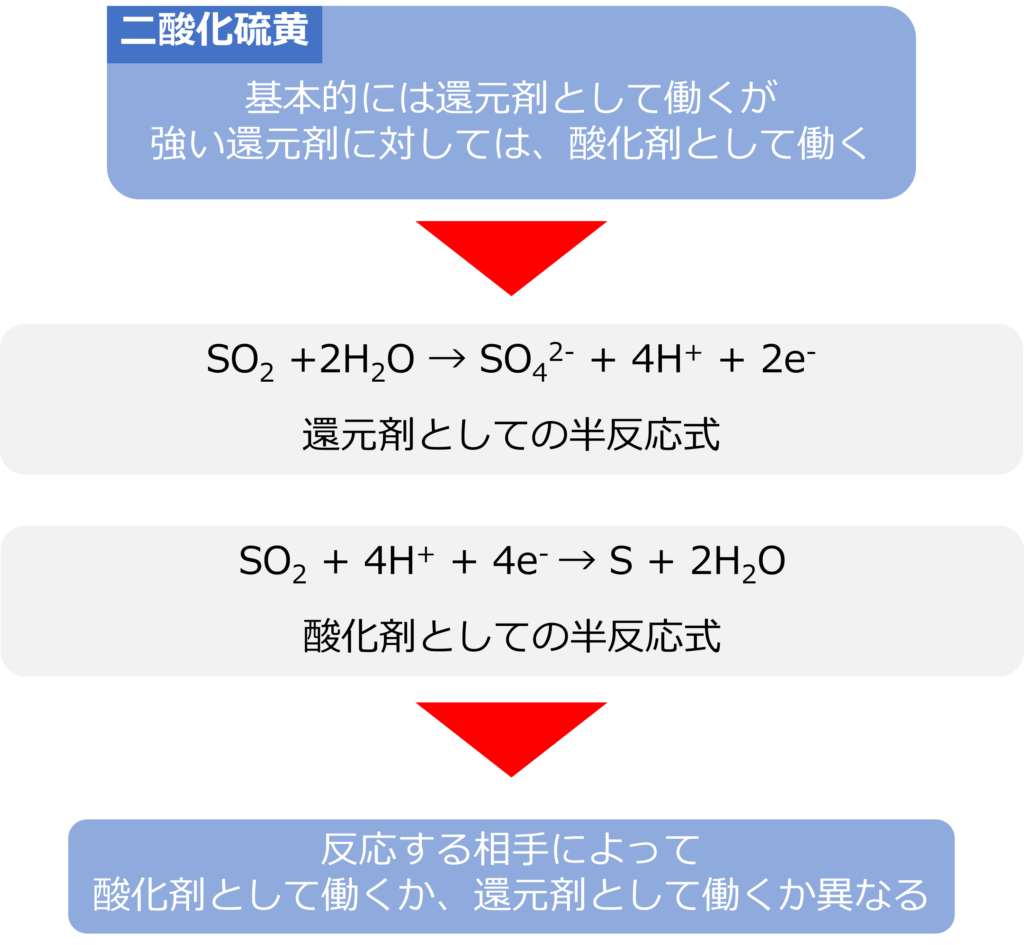
二酸化硫黄(SO2)は基本的に還元剤として働く物質ですが、二酸化硫黄などの強い還元剤と反応する際には、酸化剤としても働きます。
二酸化硫黄が酸化剤として働くときの、生成物は硫酸イオン( SO42-)であり、半反応式は以下の通りです。
SO2 +2H2O → SO42- + 4H+ + 2e–
一方、酸化剤として働くときの生成物は硫黄(S)であり、半反応式は以下の通りです。
SO2 + 4H+ + 4e– → S + 2H2O
過酸化水素や二酸化硫黄は反応する相手によって、酸化剤として働くか、還元剤として働くか異なる化合物となります。


コメント