この本や記事で分かること
・立体配座とは何か
・立体障害はなぜ、起きるのか
・エタンの立体配座とブタンの立体配座とその違い
エタンの炭素‐炭素結合の特徴は何か
エタンはC2H6で表される炭化水素であり、炭素はsp3混成軌道によって3つの水素ともう一つの炭素と結合しています。
2重結合や3重結合では、分子同士の結合を簡単に回転させることができませんが、単結合は回転させることが可能です。
エタン分子の炭素-炭素結合も単結合であり、回転が可能です。

立体配座とは何か
エタン分子の炭素ー炭素結合は360°回転可能であり、回転によって生じる原子の空間配置には様々な形があります。
このような空間配置のことを立体配座と呼びます。
様々な空間配置が可能といっても、それぞれの空間的に安定的であったり、不安定である場合があります。
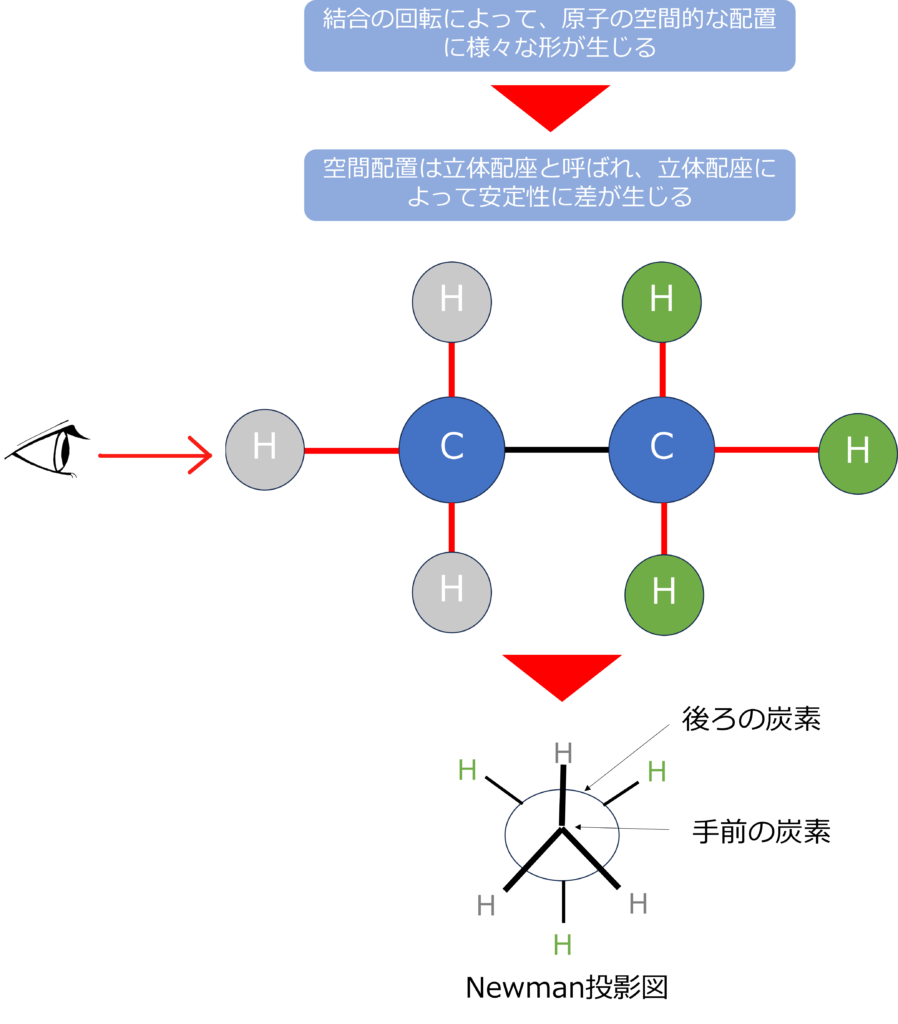
立体配座を示す際には、Newman投影図が用いられます。エタンであれば、片方の炭素を中央として、3本の水素結合を記載します。
奥の炭素結合は○で示され、おなじように3本の水素の結合を〇と結合させる形で示します。
エタンの立体配座による安定性はどう異なるのか
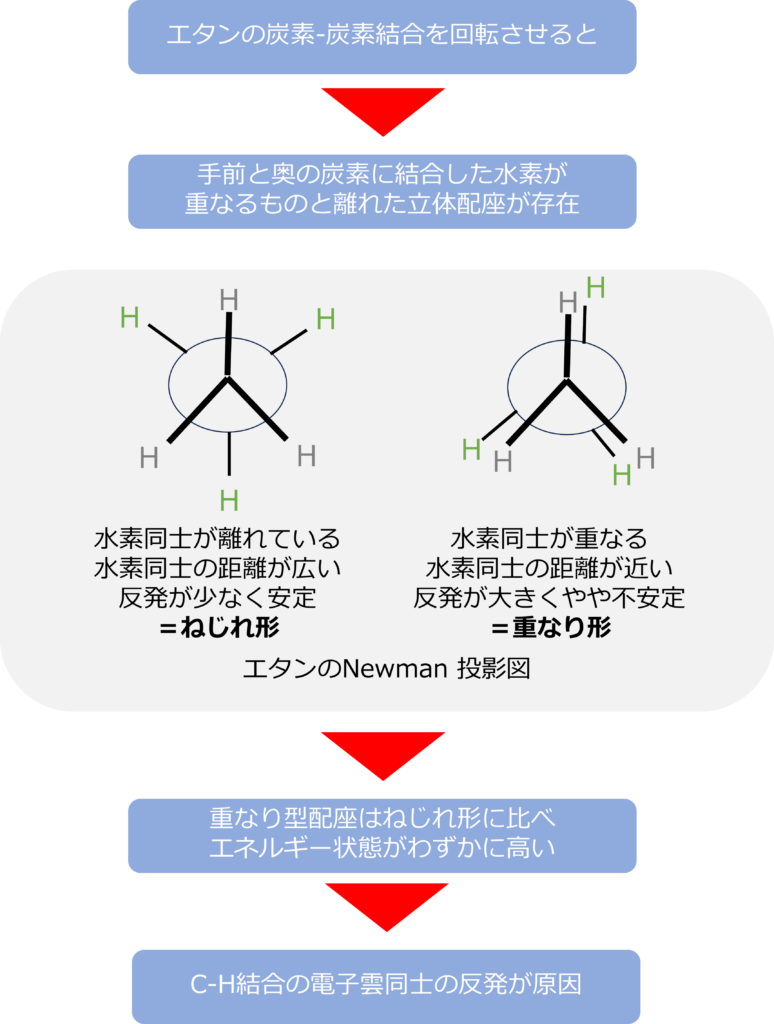
エタンを横方向から眺めて、炭素‐炭素結合を回転させると手前と奥の炭素に結合した水素が重なるような構造や水素同士が重ならないような立体配座が存在することが分かります。
水素同士が重なり合うような構造では、原子同士が近くなります。原子同士が近くなると炭素-水素結合間の電子同士が反発するためエネルギー的にやや不安定となります。
一方で、手前と奥の水素同士が重なった状態から結合を60°回転させると、水素同士の距離が最も広がり、反発が小さくなり、エネルギー的が安定となります。
水素同士が重なり合う構造を重なり形、最も離れた構造をねじれ形と呼びます。回転をすることはできますが、エネルギー的な安定には差異があります。
立体障害とは何か
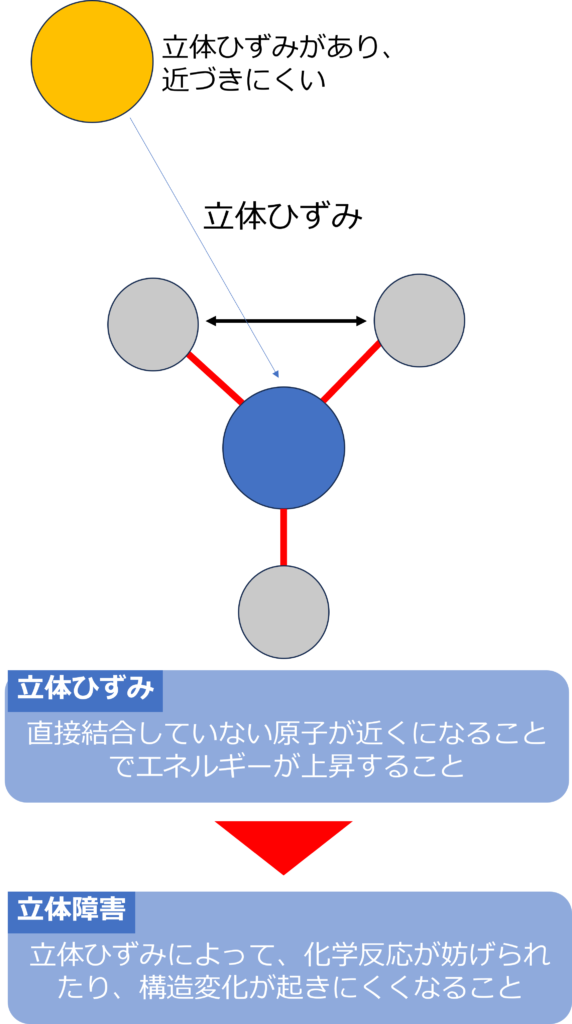
直接結合していない原子同士が近づいた立体配座をとることで、エネルギーが上昇することを立体ひずみと呼び、立体ひずみが要因となって化学反応が妨げられたり、構造の変化が起こりにくくなることを立体障害と呼びます。
化学反応は物質が衝突することで起きるため、反応点の周囲の立体障害があると反応物が反応点に近づくことが難しくなるため、反応が進行しにくくなります。
また、分子内反応など一部の反応では立体障害によって、反応点同士が近づくことで反応が進行しやすくなることもあります。
このように立体障害は化学反応の進行のしやすさに大きな影響を与えます。
ブタンの立体配座はエタンの場合とどう違うのか
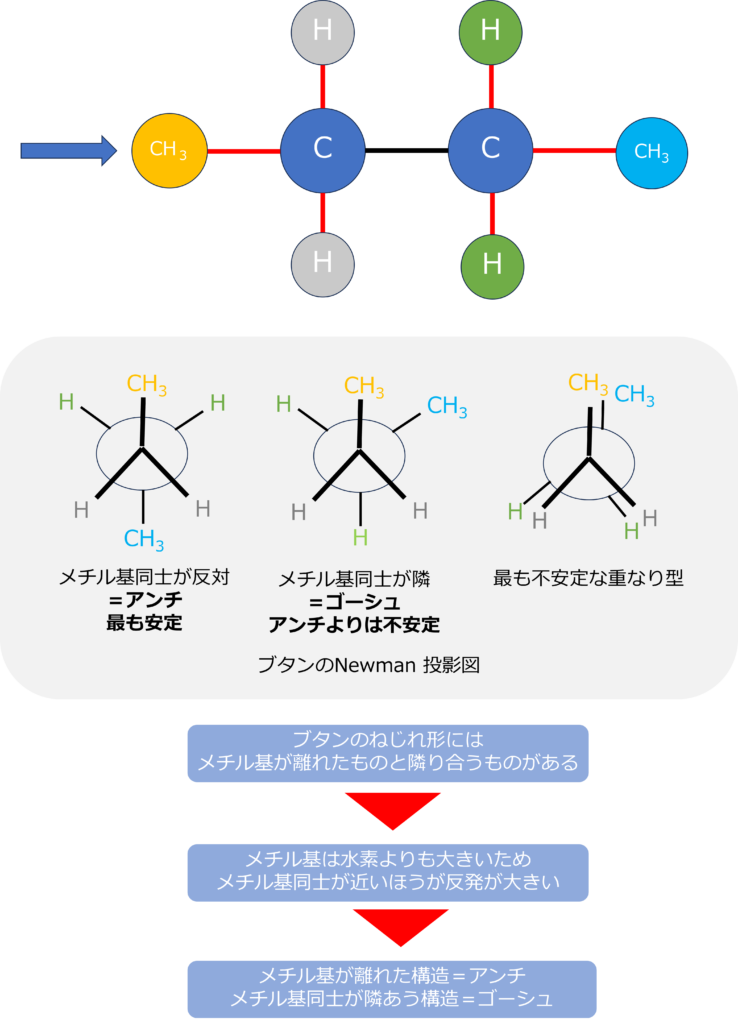
ブタン(C4H10)を中央の2個の炭素を中心にNewman投影図を書くと、それぞれの炭素に二つの水素と1つのメチル基(-CH3)が結合している形になります。
エタンのときは炭素に結合しているのはすべて水素だったため、重なり合うときも水素同士だけでしたが、ブタンでは、メチル基同士が重なる場合と、メチル基と水素が重なる場合の2通りが存在しています。
メチル基は水素よりも嵩が大きいため、メチル基同士が重なり合うほうが、水素と重なり合うときと比べて、エネルギーが高い状態になります。
また、ねじれ構造にもメチル基同士が隣り合うとき(角度が60 or 300°)のときと、正反対の位置にある(180°)の場合があります。
最も安定になるのはメチル基同士が最も離れた180°のときとなります。この時のねじれ配置をアンチ型、隣り合うときをゴーシュ型と呼びます。
結合する官能基の種類が増加することで、ねじれ型、重なり型の中でもエネルギー状態に差が出るようになっていきます。


コメント