・電気分解とは何か
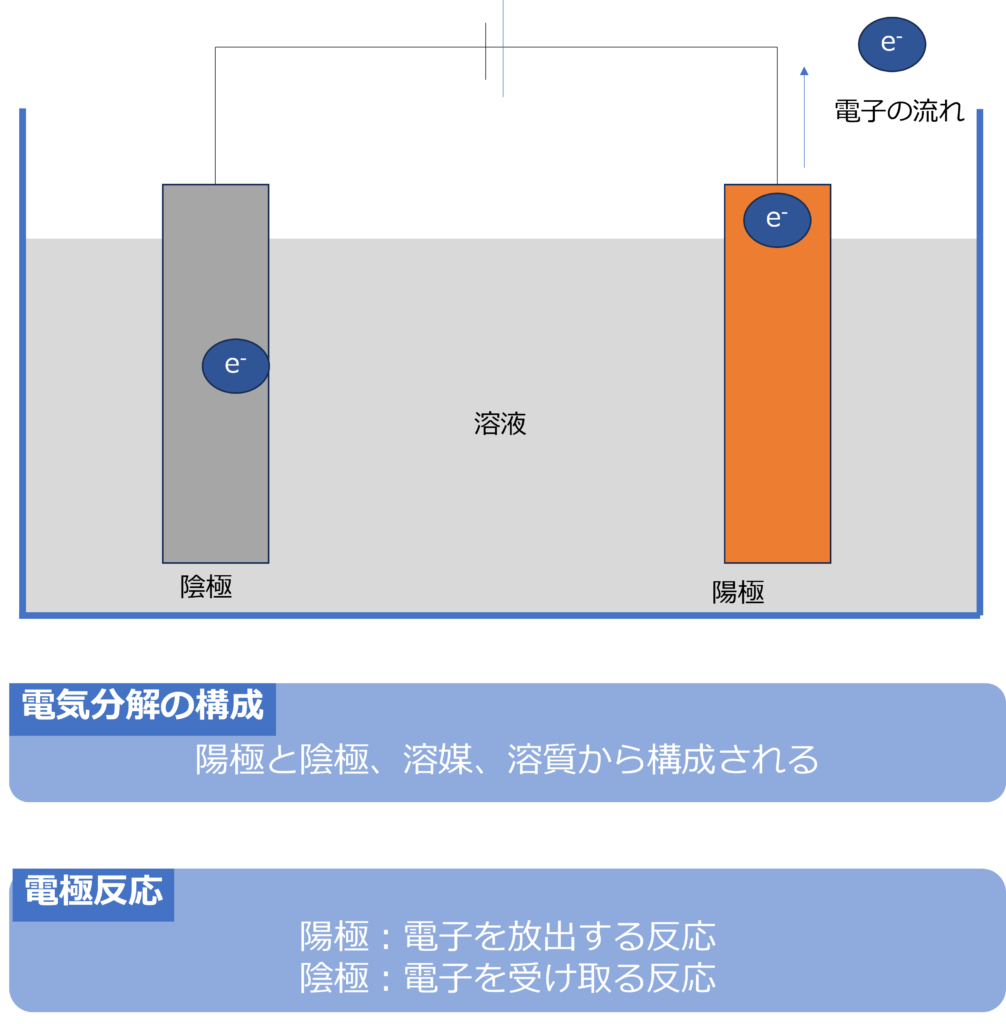
・電気分解の構成要素
・様々な水溶液での電気分解の反応
この本や記事で分かること
電気分解と電池の違いはなにか
電池は化学反応を電気エネルギーに変換するものでしたが、外部から電気エネルギーをかけることで、化学反応を起こすことも可能です。
例えば、水に電極を浸し、電気を流すと、水は電気によって反応し、分解されます。このような反応を電気分解と呼びます。

電気分解には何が必要か
電気分解の構成要素は電池と同じで、電極、溶質、溶媒からなっています。
電池では負極で電子を放出しやすい物質が電子を放出し、陽極では電子を受け取ることで、電子が移動し、電流が流れていました
電気分解では、電池の正極をつないだほうを陽極、負極とつないだほうを陰極とします。
電気分解では、外から電流が流れているため、陰極には電子が豊富な状態となり、電子を受け取りやすい物質が反応し、陽極では電子を放出しやすい物質が反応しています。
水酸化ナトリウム(NaOH)溶液を電気分解すると何が起きるか
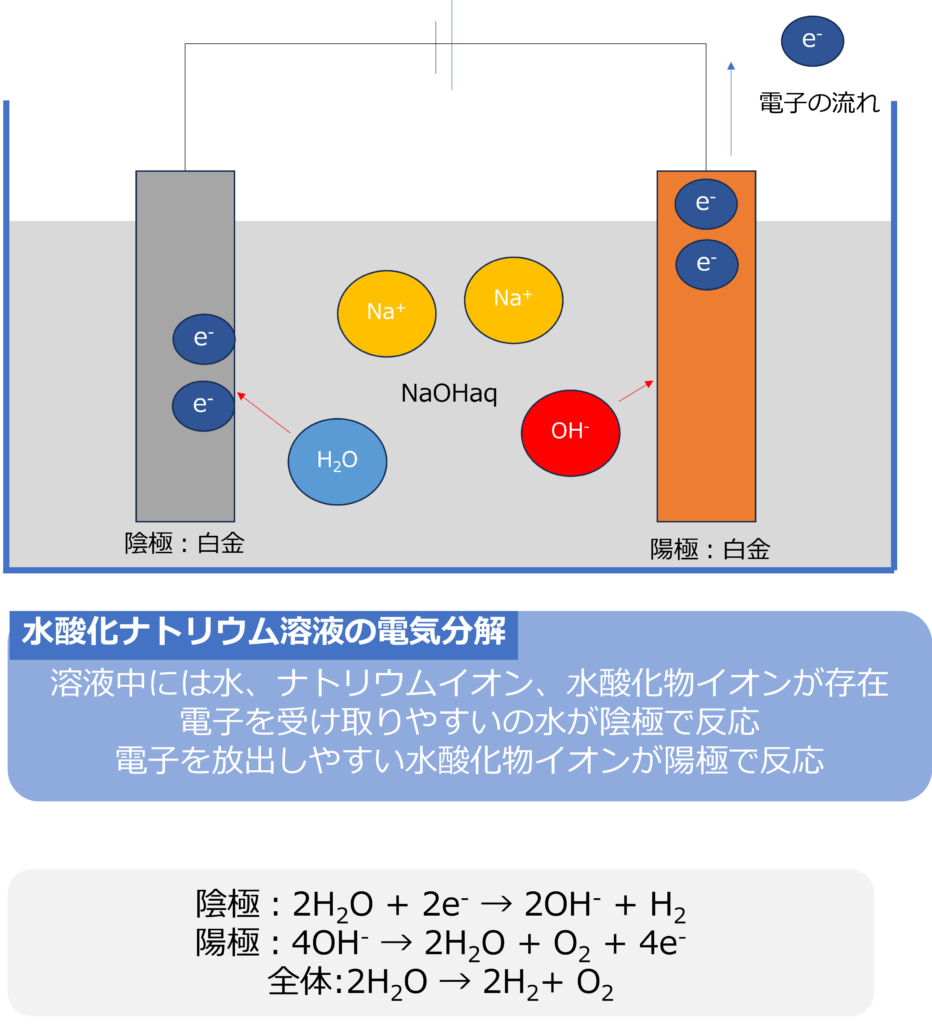
水酸化ナトリウム(NaOH)溶液を使用し、電極に白金を使用して電気分解を行うと以下のような反応が起きます。
主に溶液中に存在するのは、水(H2O)とナトリウムイオン(Na+)、水酸化物イオン(OH–)の3つとなります。
このうち最も電子を受け取りやすいには、水であり水酸化物イオンと水素が生成します。
陰極:2H2O + 2e– → 2OH– + H2
電子を放出しやすのは、水酸化物イオンであり、電子を放出し水と酸素を放出します。
陽極:4OH– → 2H2O + O2 + 4e–
陰極と陽極の反応をまとめると、水が電気によって水素と酸素に分解される反応となります。
全体:2H2O → 2H2+ O2
水溶液を電気分解するとどのような反応が
水溶液中の場合、水よりも電子を受け取りやすい=還元されやすい物質があれば、その物質が電子を受け取り、水よりも電子を放出しやすい=酸化されやすい物質があればその物質は電子を放出し、反応が進行します。
水よりも酸化されやすい物質としては、塩化物イオン(Cl–)や水酸化物イオン(OH–)などが、還元されやすい物質としては、銅イオン(Cu2+)や水素イオン(H+)などが挙げられます。
水酸化ナトリウムでは、Naイオンはイオン化傾向が高く、還元されにくいため陰極では水が反応し、陽極では、水よりも酸化されやすい物質である水酸化物イオンが反応しています。

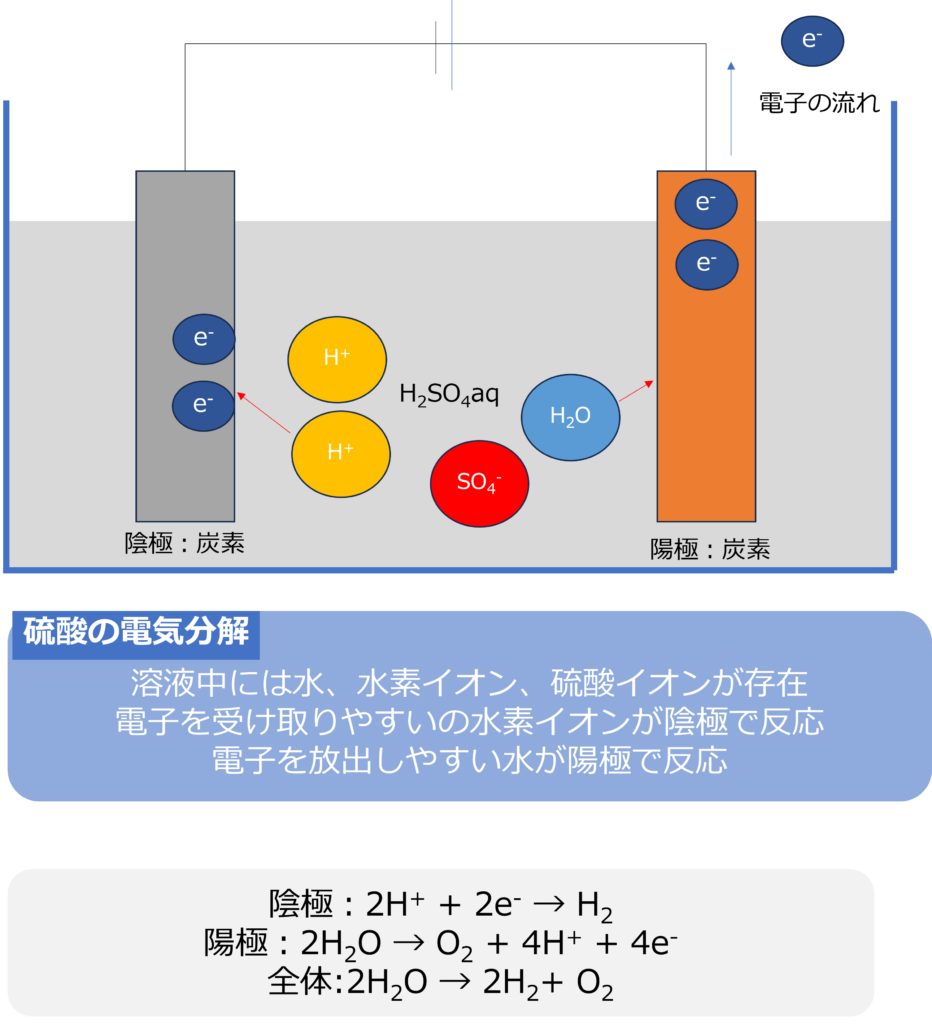
硫酸を電気分解するとどうなるのか
硫酸を炭素電極を用いて、電気分解を行うと、溶液中には水(H2O)と水素イオン(H+)、硫酸イオン(SO42-)の3つが主に存在します。
水素イオンは水よりも還元されやすいため、陰極では水素イオンの還元反応が起きます。
陰極:2H+ + 2e– → H2
硫酸イオンは水よりも酸化されにくいため、陽極では水が電子を放出する反応が起きます。
陽極:2H2O → O2 + 4H+ + 4e–
全体でみると、水酸化ナトリウムと同じく水の電気分解が発生していることが分かります。
全体:2H2O → 2H2+ O2
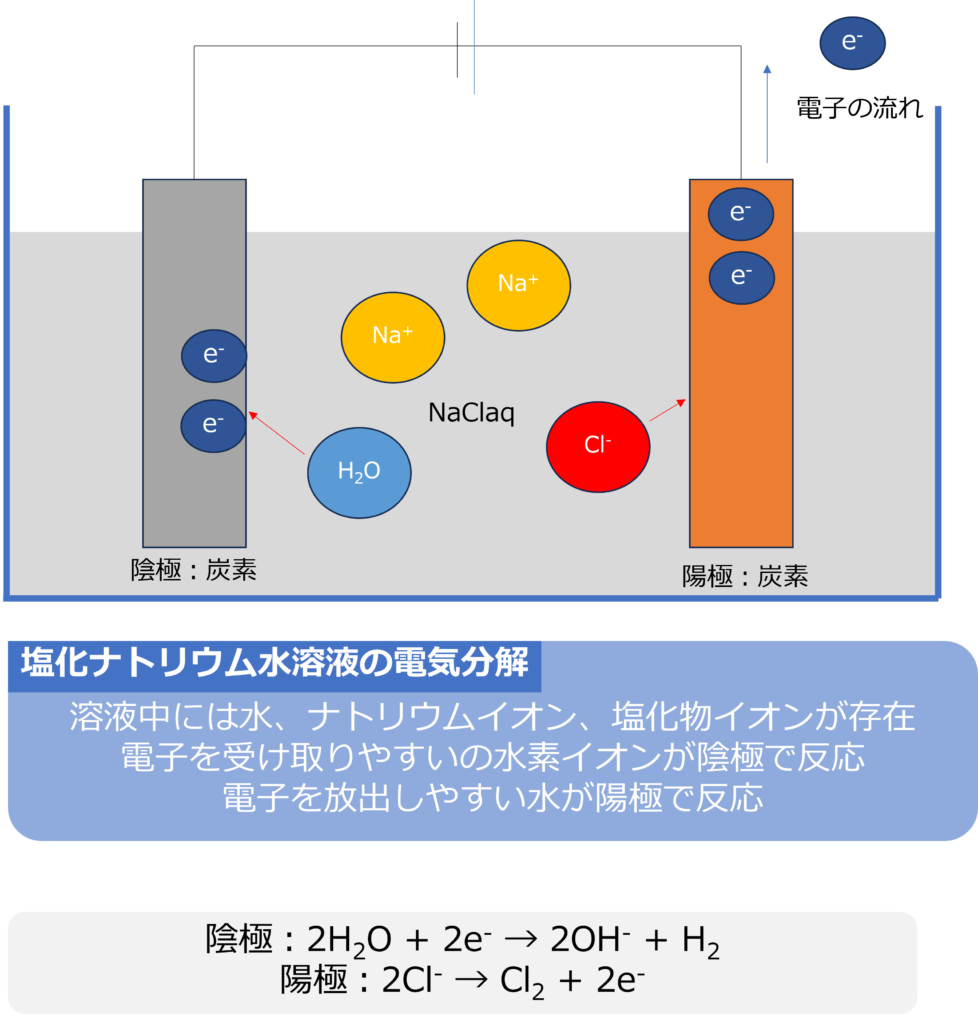
塩化ナトリウム水溶液を電気分解するとどうなるのか
塩化ナトリウム水溶液を炭素電極を用いて、電気分解を行うと、溶液中には水(H2O)とナトリウムイオン(Na+)、塩化物イオンCl–)の3つが主な物質となります。
陰極では水が電子を受け取り、塩素が発生します。
陰極:2H2O + 2e– → 2OH– + H2
塩化物イオンは水よりも還元されやすいため、陽極では塩化物イオンが電子を放出し、塩素を生成する反応が起きます。
陽極:2Cl– → Cl2 + 2e–
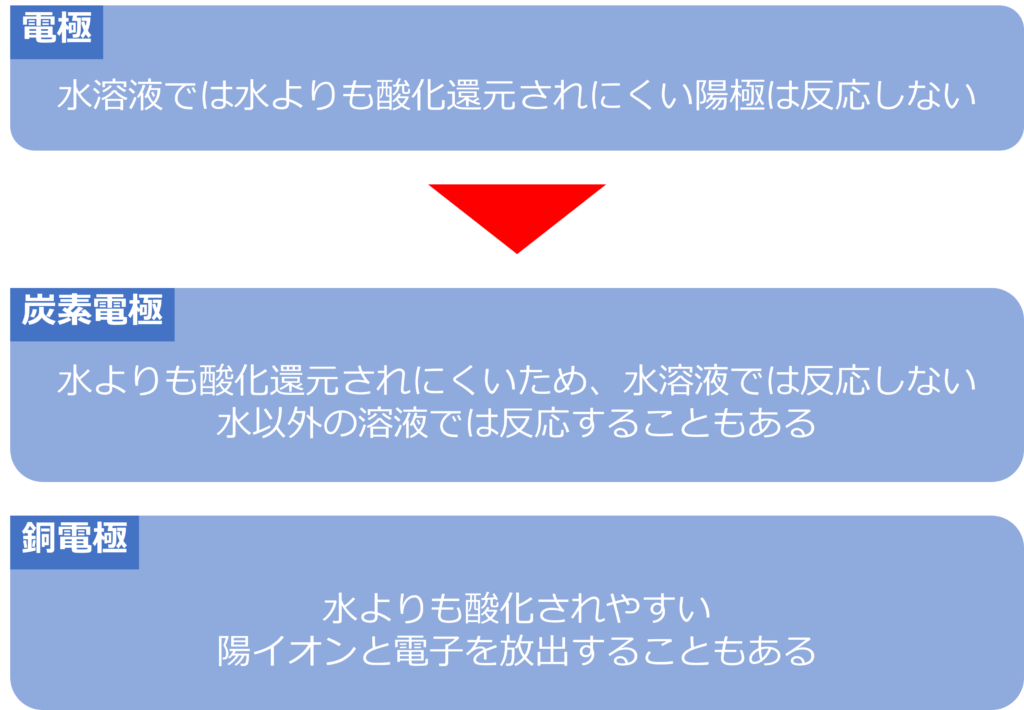
電極の種類で電気分解の反応はどう変わるのか
炭素や白金を電極として、利用している場合、水と比較して酸化還元されにくいため、水溶液の電気分解では、変化することはありません。
銅は水と比較して、酸化されやすいため銅を陽極に使用すると、陽極が溶けだし、陽イオンと電子を放出することがあります。
陽極:Cu → Cu2+ + 2e–
また、水以外の溶液を使用し、溶液よりも炭素のほうが酸化還元されやすい場合、炭素電極が反応することもあります。


コメント