この本や記事で分かること
・可逆反応と不可逆反応の違い
・化学平衡、平衡定数とは何か
・ルシャトリエの原理とどんな時に平衡が移動するのか
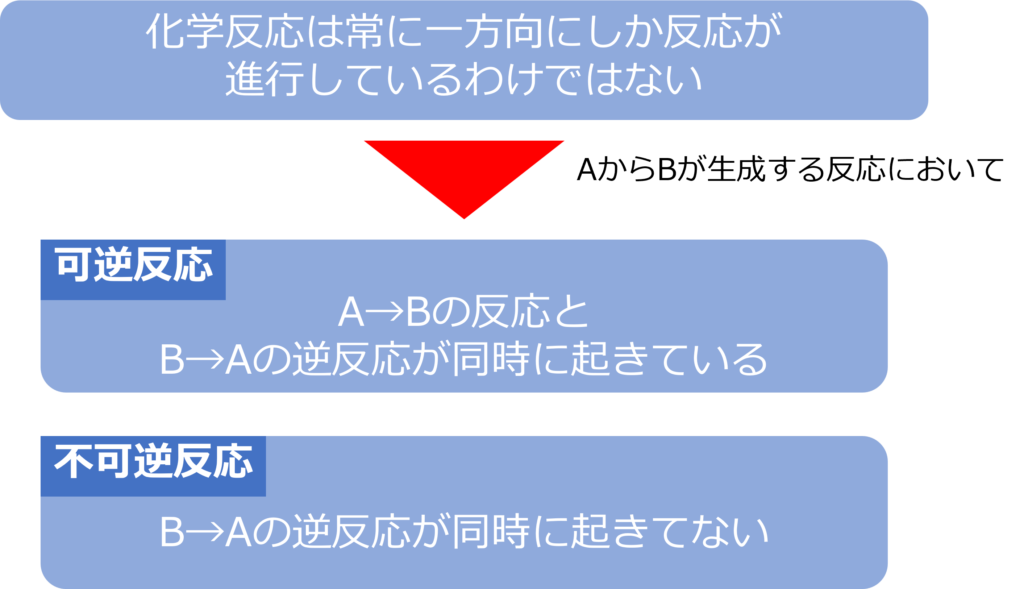
化学反応は常に一方向に進行するのか
化学反応は常に一方にしか反応が進行しないわけではありません。
原料Aから生成物Bが生成する反応(A → B)において、B→Aの逆反応も同時に起きている場合、そのような反応は可逆反応と呼ばれます。反応が可逆反応であるときは両矢印(⇄)が反応式に利用されます。
A ⇄ B
一方、逆反応が起きない反応は不可逆反応と呼ばれます。
B→Aの逆反応が発生しない反応だけでなく、生成物であるBが別の物質に変化してしまったり、系外に放出されるため逆反応が起きない反応も不可逆反応と呼ばれます。
ただし、不可逆反応であっても、反応条件を変更したり、触媒などを加えることで、逆反応を起こすことができることはあります。
化学平衡とは何か
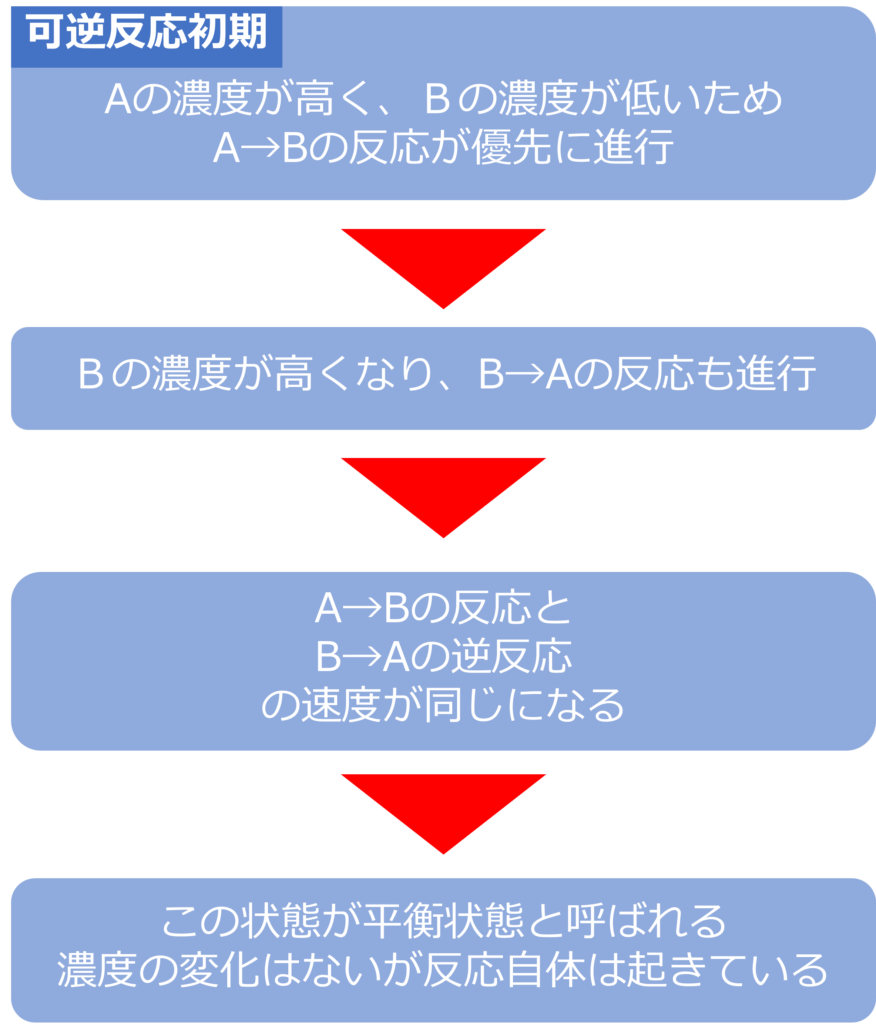
可逆反応(A ⇄ B)において、反応初期はAの濃度が高く、Bの濃度が低いため、A→Bの反応が進行していきます。
徐々にBの濃度が高くなると、B → A の反応も起きやすくなり、A→Bの反応と同時に進行するようになります。
反応がA→Bの反応とB→Aの逆反応の速度が同じになり、AとBの濃度の割合が一定になることがなります。
このような正反応と逆反応の速度が同じになった状態を平衡状態と呼びます。平衡状態では、濃度の変化はありませんが、反応が起きていないわけではなく、反応自体は進行しており、正反応と逆反応の速度が同じになっています。
平衡定数とは何か
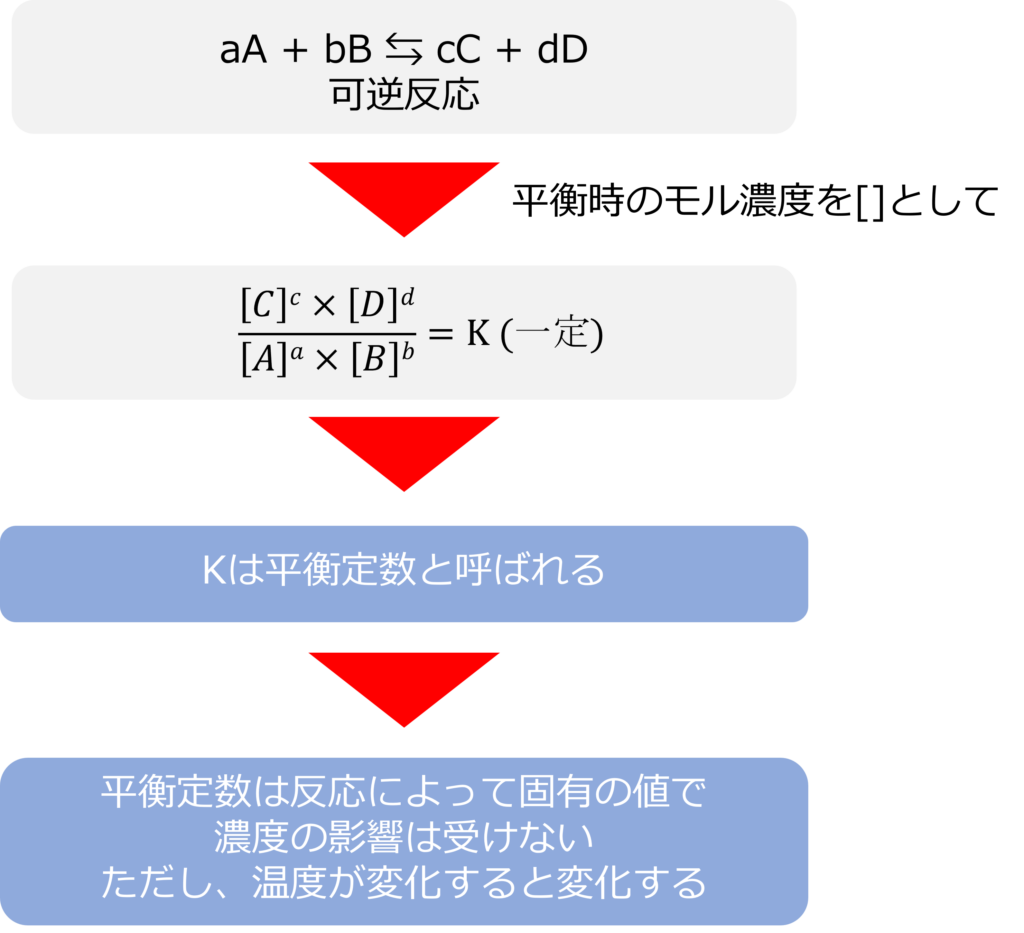
以下のような可逆反応が平衡状態の時には定数をKとして、以下のような関係が成り立ちます。
aA + bB ⇆ cC + dD
\begin{aligned},\\
\dfrac{\left[ C\right] ^{c}\times \left[ D\right] ^{d}}{\left[ A\right] ^{a}\times \left[ B\right] ^{b}}=K\end{aligned}
[A]は平衡時のAのモル濃度[mlo/L]を表し、kは平衡定数と呼ばれます。
平衡定数Kが大きいことは、平衡時の反応の生成物の量が多いことを示しているため、平衡定数が大きいほど反応が右側に傾いていることを表しています。
平衡定数は反応によって固有の値をとり、反応物や生成物の濃度には依存しません。ただし、温度の影響を受けるため、温度が変化すると平衡定数も変化します。
ルシャトリエの原理とは何か
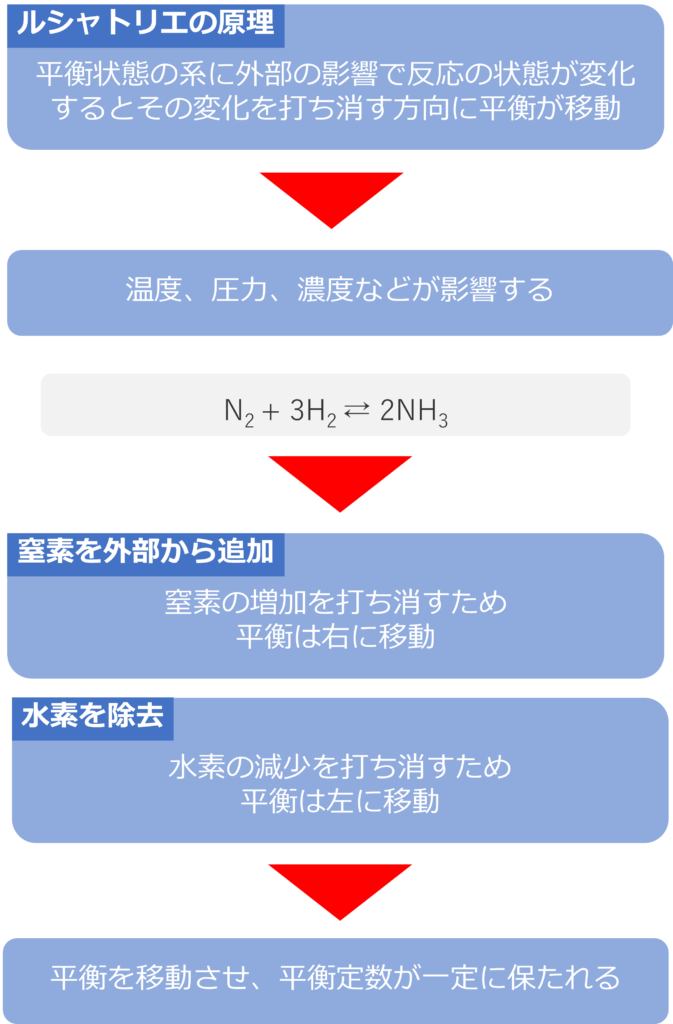
化学平衡状態にある系内で、外部からの影響で反応の状態を変化させると、平衡はその変化を打ち消す方向に変化します。
このような変化はルシャトリエの原理と呼ばれ、変化する反応の状態には、温度、圧力、濃度が挙げられます。
窒素と水素からアンモニウムが生成する反応は可逆反応であり、以下のような反応式となります。
N2 + 3H2 ⇄ 2NH3
この反応が平衡にあるときに窒素を外部から追加すると、窒素の量が増加することになります。系内の変化を打ち消す方向に進むため、反応は右方向に平衡が移動します。
窒素の濃度が上昇すると、平衡定数は小さくなります、平衡定数は系内の濃度によらず一定となるため、アンモニアの濃度が上がるように反応が右側に移動することで、平衡定数を一定に保っています。
同じように水素を除去すれば、平衡定数が大きくなるため、反応は左側に傾くようになります。
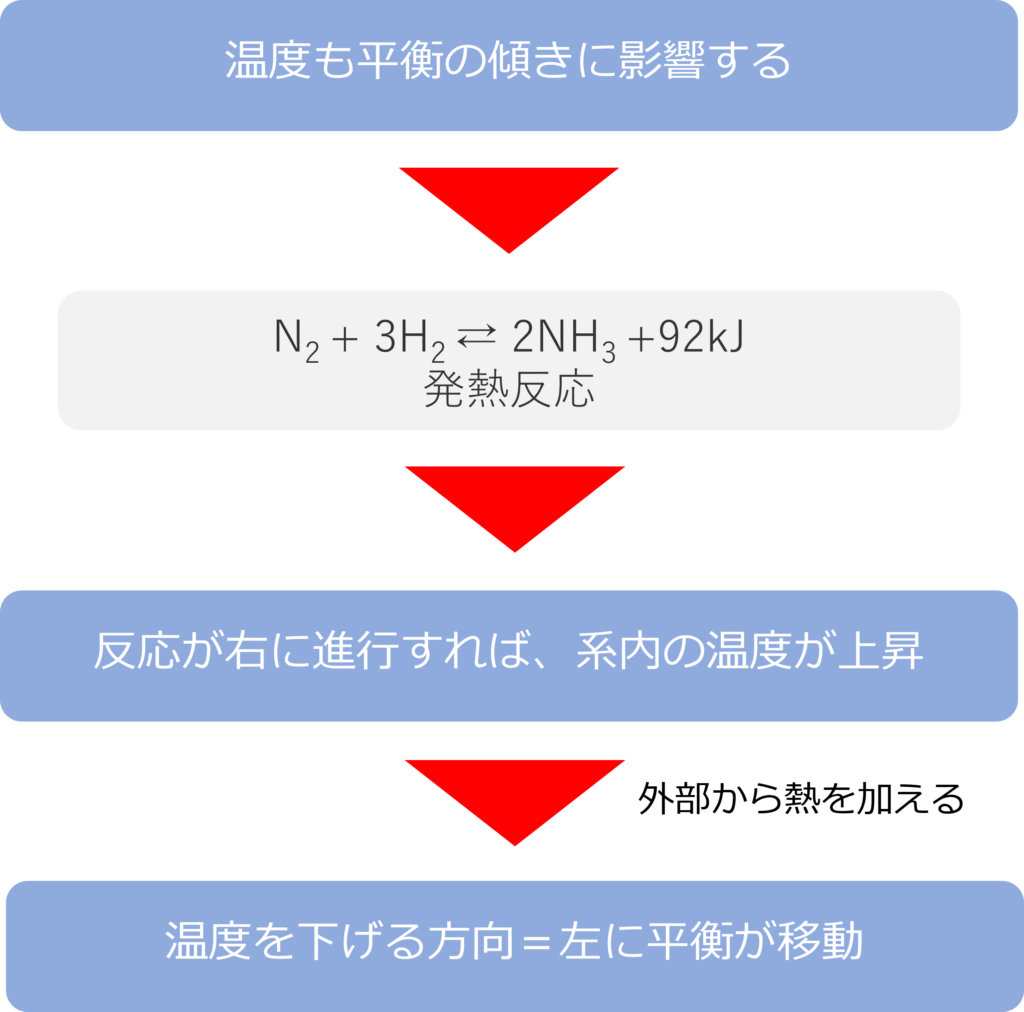
温度は平衡にどう影響するのか
温度の上昇も反応の傾きに影響を及ぼします。窒素と水素からアンモニウムが生成する反応は発熱反応であり、以下のような反応式となります。
N2 + 3H2 ⇄ 2NH3 + 92kJ
この反応は発熱反応であるため、反応によって熱が生じ、系内の温度は上昇します。
外部から熱を加え温度を上げると、ルシャトリエの原理から温度を下げる方向に平衡が移動するため、反応は左に傾きます。
逆に温度を下げると、温度上げる方向に平衡が移動するため、反応は右側に傾くことになります。
圧力は平衡にどう影響するのか
圧力の変化も平衡が移動する要因となります。
N2 + 3H2 ⇄ 2NH3
気体の圧力は系内の分子の数が多いほど大きく、少ないほど小さくなります。上記の反応は1分子の窒素と3分子の水素から2分子のアンモニアが生成する反応となります。
そのため、反応が右に傾くほど分子の数が減り、圧力は小さくなり、左に傾くほど分子の数が増えるため大きくなることとなります。
外部から圧力を加えると、平衡は圧力を下げる方向=右に傾き、圧力を下げると平衡は圧力を上げる方向=左側に傾きます。

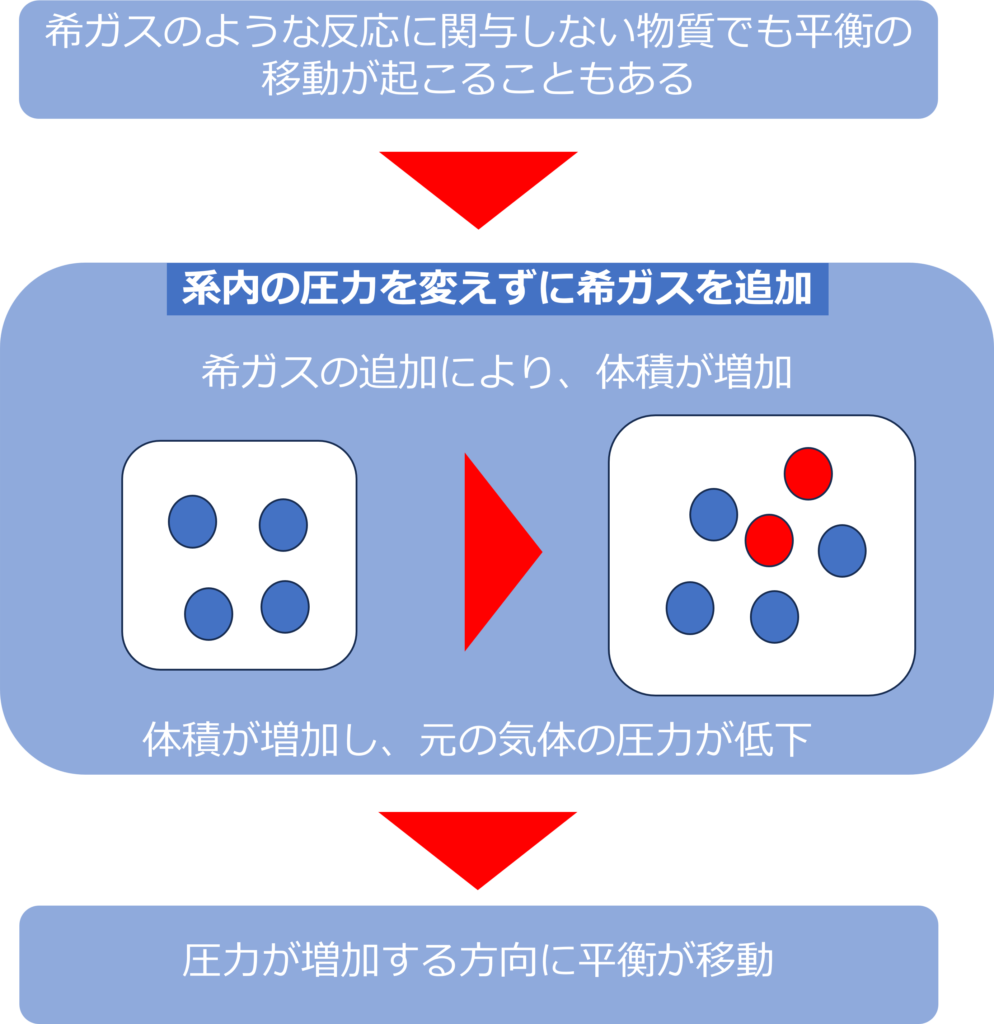
反応に関与しない物質で平衡が移動することはあるのか
希ガスのような反応に関与しない物質を加えることでも平衡が移動することがあります。
系内の圧力を変えずに、希ガスを系内に加えると、体積が増加します。系内の圧力を変えていない場合系内の圧力=各気体の圧力の和となります。
そのため、希ガスを加えた分、反応に関与するもともとの気体の圧力が下がることになり、平衡は圧力が増加する方向=左に傾くこととなります。
一方、体積を変えずに希ガスを加えたときは、系内の条件に変化はなく平衡は移動しません。


コメント