この本や記事で分かること
・イオン化傾向の大きい金属を電気分解で析出させる方法はあるのか
・溶融電気分解
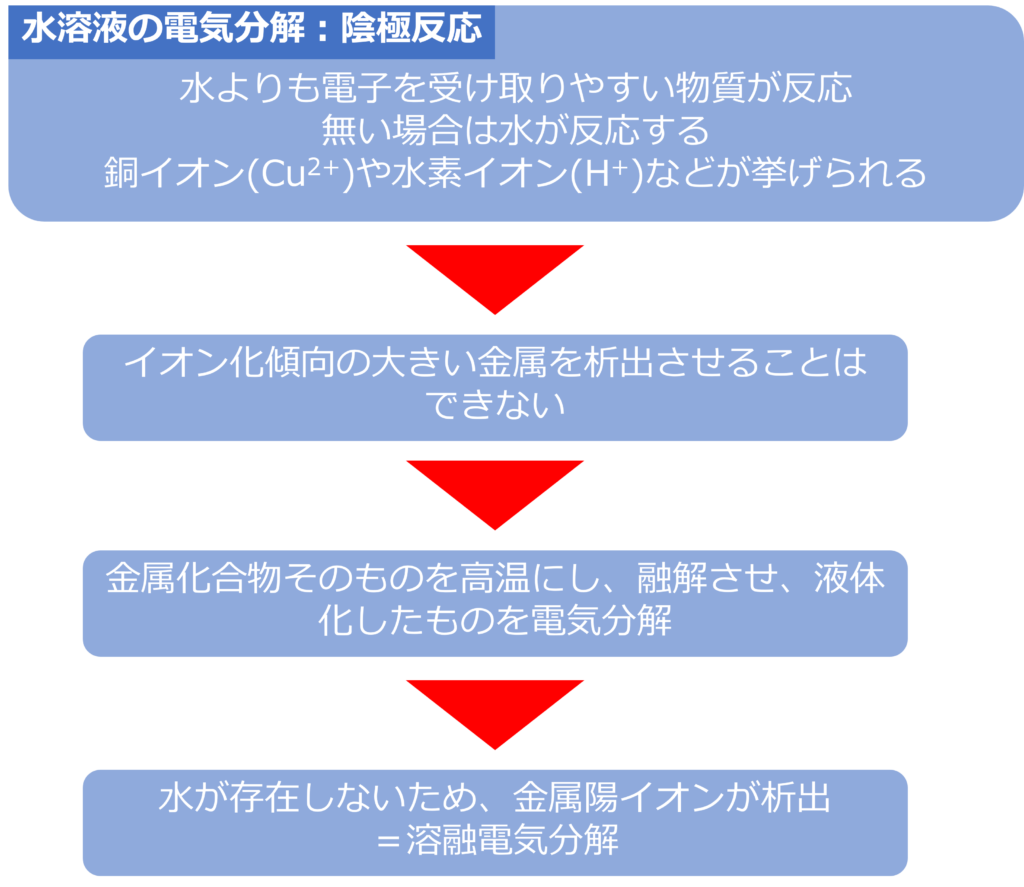
イオン化傾向の大きい金属を電気分解で得ることことはできるのか
イオン化傾向の大きな金属を含む水溶液を使用し、電気分解を行っても、陰極では、金属が析出するのではなく、水が水素に分解されてしまいます。
イオン化傾向の大きい金属を析出させたい場合は、水に金属化合物を溶かして、水溶液を電解するのではなく、金属化合物そのものを高温にし、液体にした状態で電気分解を行います。
このような手法は金属化合物を溶かして(溶融状態)、電気分解を行う手法であるため、溶融塩電気分解と呼びます。
塩化ナトリウムの溶融電気分解では何が起きるのか
溶融塩電気分解は、ナトリウム(Na)やアルミニウム(Al)などイオン化傾向の大きい金属を単体で得るために使用されています。
塩化ナトリウムを水に溶解した水溶液を電気分解を行っても、陰極では、ナトリウムの析出は起こらず、水の電気分解で水素が発生してしまいます。
陰極:H2O + 2e– → H2 + 2OH– + H2
塩化ナトリウムを水に溶かすのではなく、熱をかけることで、液体状態にし、電気分解を行うと、水が存在しないため、陰極では、ナトリウムが電子を受け取り、ナトリウムを析出させることが可能になります。
陰極:Na+ + e– → Na

アルミニウムはどのように製造されているのか
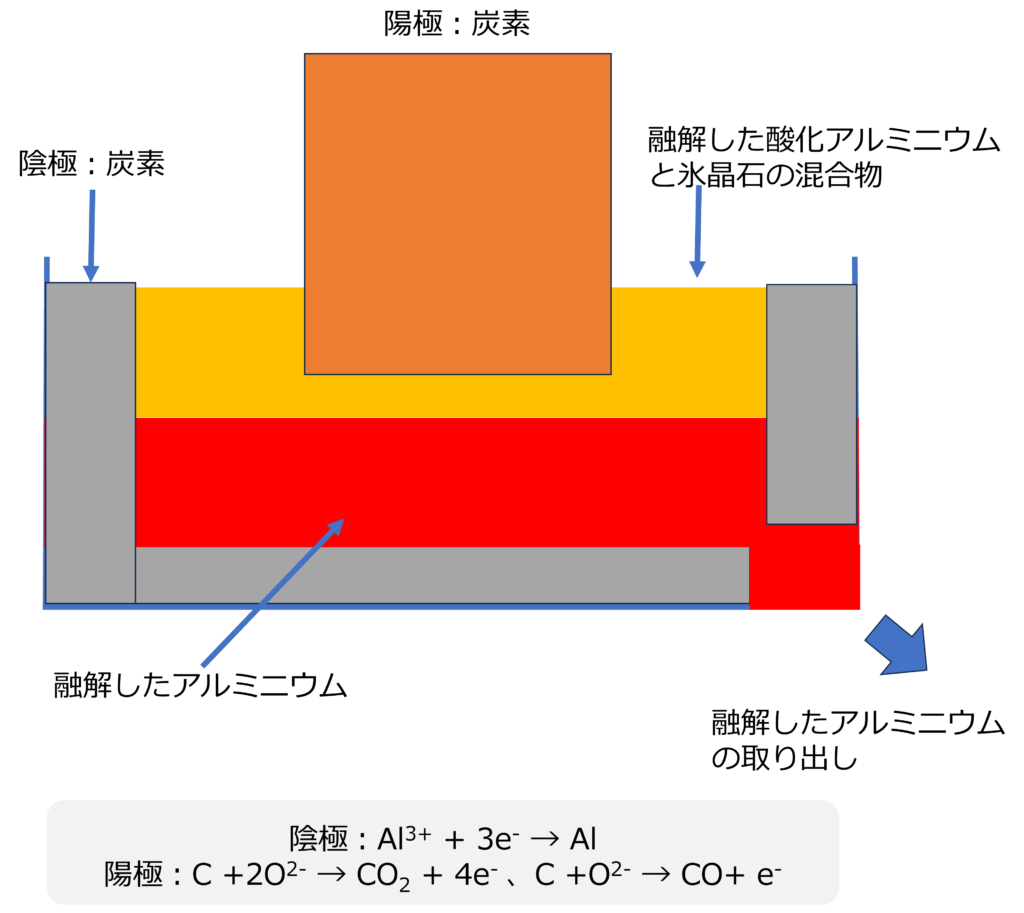
アルミニウムは鉱石であるボーキサイトから酸化アルミニウム(Al2O3)を生成し、水ではなく氷晶石とよばれるフッ化物とともに1000℃の熱をかけ、溶融させた状態で電気分解し、製造しています。
陰極では、溶融し、イオン化したアルミニウムが電子を受け取り、アルミニウムが析出する反応が発生しています。
陰極: Al3+ + 3e– → Al
陽極には炭素電極が使用されます。
水が存在しないため、炭素電極が酸化され、二酸化炭素や一酸化炭素へ変化し、電子を放出しています。
陽極:C +2O2- → CO2 + 4e– 、C +O2- → CO+ e–
氷晶石を使う理由は何か
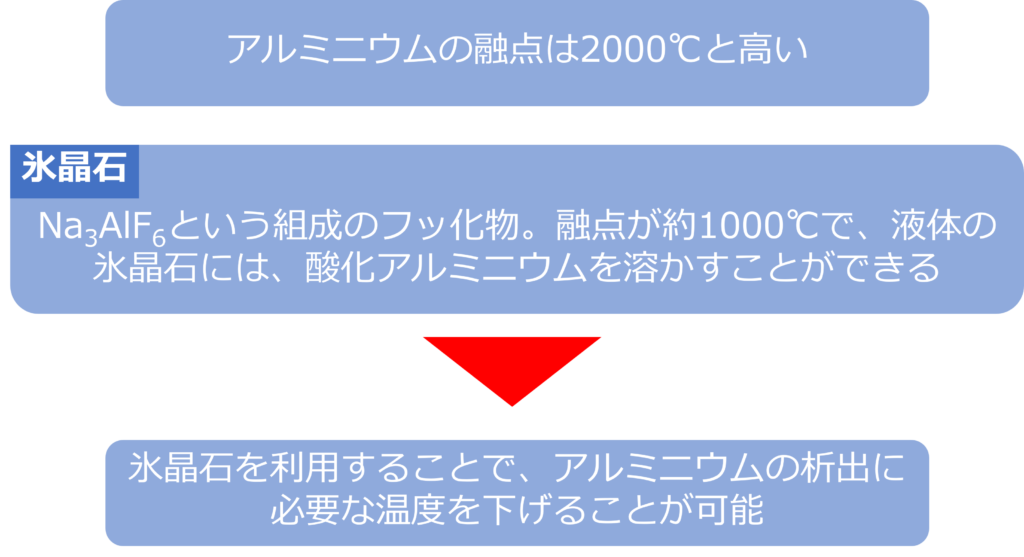
氷晶石はNa3AlF6という組成のフッ化物です。
酸化アルミニウム単体を溶融させようとすると2000℃以上と高い温度が必要になります。
氷晶石の融点は約1000℃であり、液体になった氷晶石には、酸化アルミニウムを溶かすことができます。
氷晶石を利用することで、アルミニウムの析出に必要な温度を下げることが可能になっています。
氷晶石を利用したアルミニウムの溶融塩電気分解法は発見者にちなんで、ホール・エルー法と呼ばれ、現在も工業的にアルミニウムが作られています。
なぜ、電極に炭素を使用するのか
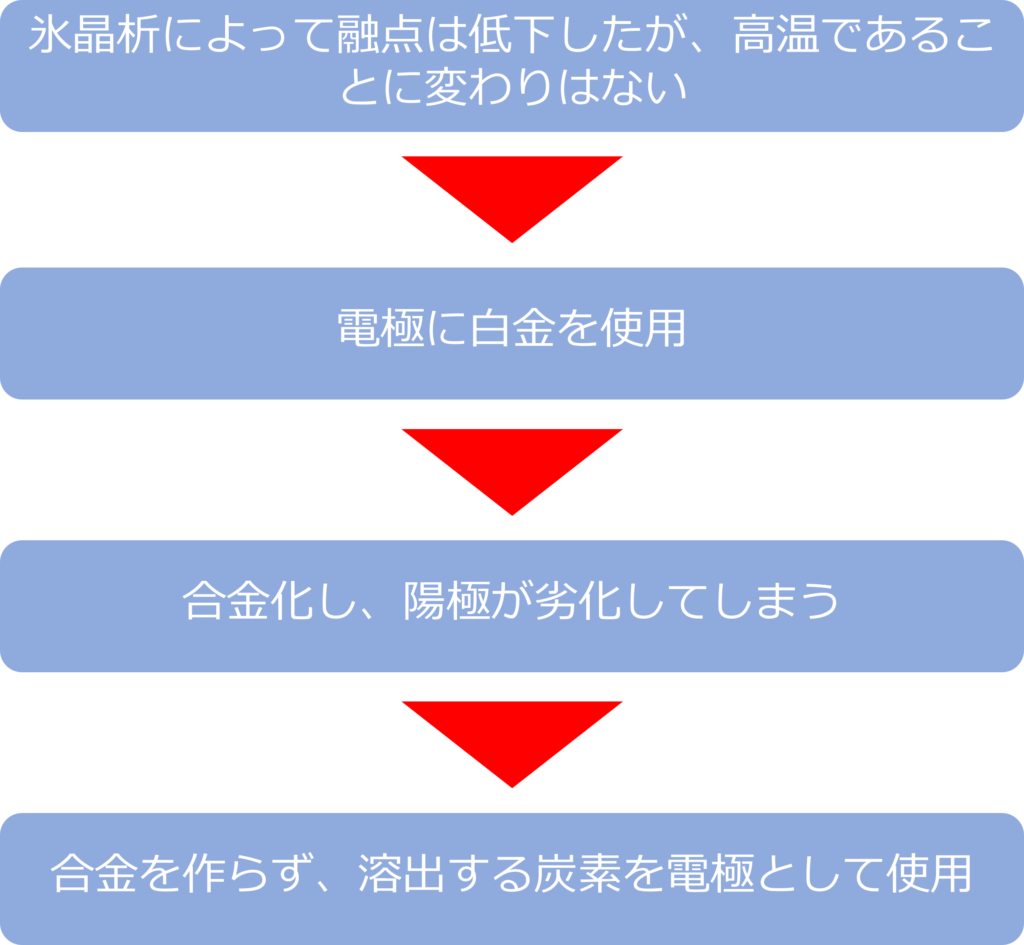
氷晶析によって、温度を1000℃を下げることは、可能になりましたが、高温であることに変わりはありません。
このような高温条件で電極に白金を使用すると、合金化してしまい陽極が劣化してしまいます。
そのため、ホール・エルー法では、炭素電極を使用しています。
炭素は合金を作ることはないため、高温化では溶解し、二酸化炭素や一酸化炭素となり、溶出していきます。
アルミナ自体は豊富に存在していましたが、製造コストがとても高く、アルミニウムの価格は金や銀よりも高いものでした。
ホール・エルー法の完成によって、アルミニウムの価格は大きく下がり、様々な場面で利用されています。
ホール・エール法にも電流効率の悪さ、氷晶石による腐食の発生、電極の消耗があるなどの欠点もありますが、代替となる方法は見つかっていません。


コメント