この本や記事で分かること
・電極反応で反応する物質の量は何で決まるのか
・ファラデーの法則とは何か
・ファラデーの法則を使って、電気分解の反応量を計算するにはどうすれば良いのか
電極での反応量はなにで決まるのか
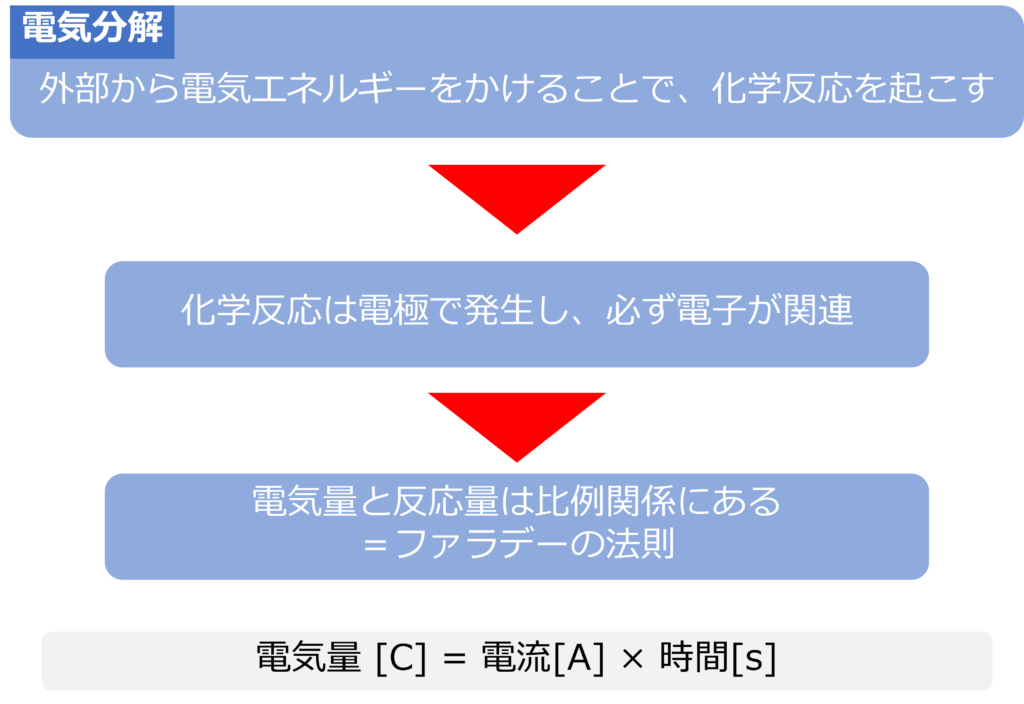
電気分解は外部から電流を流すことで、電極での化学反応を起こしています。
電極での反応には必ず、電子に移動が関わっており、反応がどれくらい起こるのかは、電子の移動量=電気量によって決まっています。
電気量と電極での反応量は比例関係にあり、流した電流に比例して、電極での物質が反応する量が変化します。
電気量はクーロン[C]という単位を使用し表され、以下のように電流と時間の掛け算で表されます。
電気量 [C] = 電流[A] × 時間[s]
電気量[C]と電極で変化する物質の物質量[mol]は比例関係にあり、この法則はファラデーの法則と呼ばれます。
ファラデーの法則とは何か
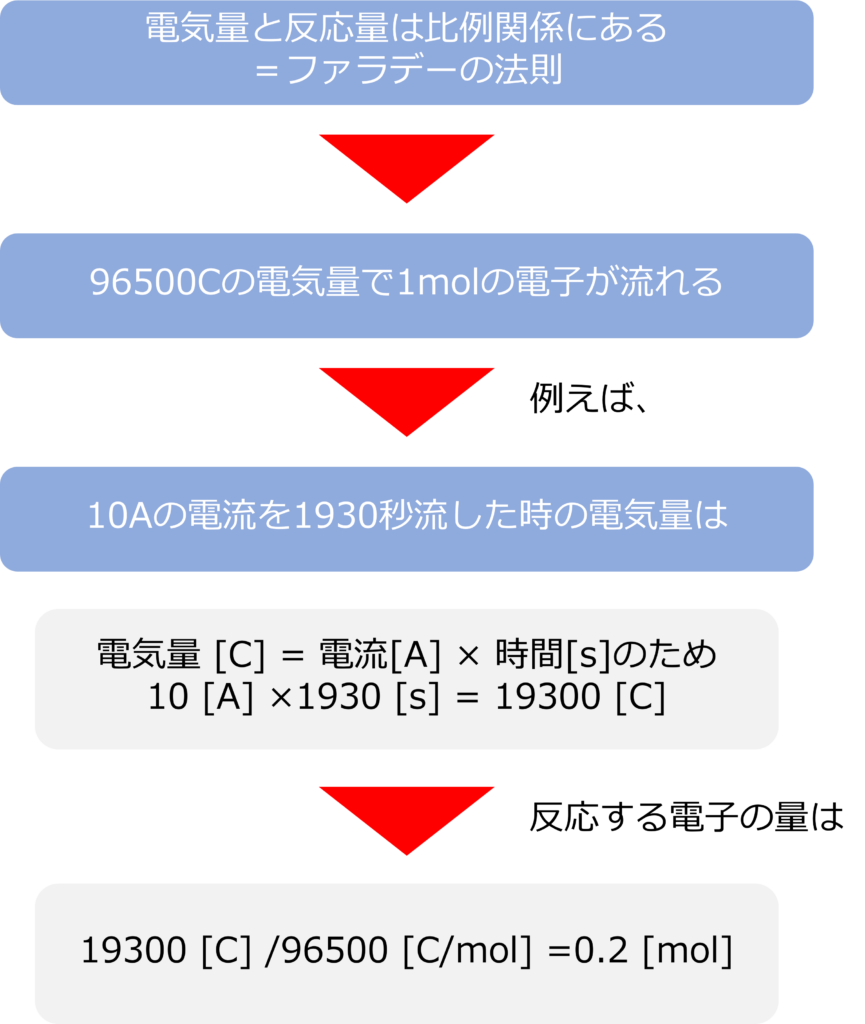
1molの電子の持つ電気量1ファラデーであり、1F = 96,5000[C/mol]となります。96,500はファラデー定数と呼ばれます。
96,500Cの電気量が流れれば1molの電子が流れ、電極反応が進行することとなります。
例えば、10Aの電流を1930秒流した時の電気量は
10 [A] ×1930 [s] = 19300 [C]
となり、反応する電子の量は
19300 [C] /96500 [C/mol] =0.2 [mol]
となります。
電気量から反応量はどのように計算できるのか
10Aの電流を1930秒流した時に電子は0.2mol反応することになります。陰極での反応が銅の析出であった場合、反応式は以下のようになり、銅の析出する量を計算することが可能です。
Cu2+ + 2e– → Cu
0.2molの電子が流れたため、銅は0.1mol析出することとなります。銅の分子量を63.5とすると、析出する銅は
0.1 [mol] ×63.5[g/mol] = 6.35[g]
となります。

反応量から必要な電気量を求めるのはどうすれ良いのか
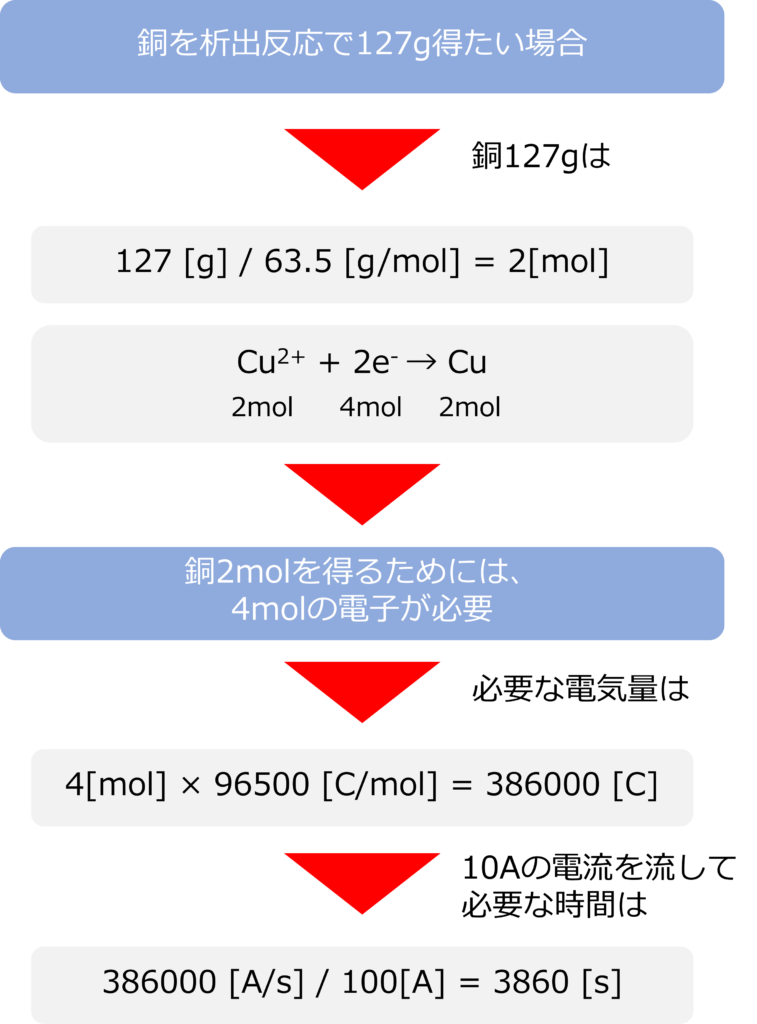
ファラデーの法則を利用することで、金属を必要量析出させるために、どれくらいの電気量が必要か計算することができます。銅の析出反応を利用し、銅を127g得たい場合には以下のような計算を行います、
Cu2+ + 2e– → Cu
銅127gは
127 [g] / 63.5 [g/mol] = 2[mol]
であり、2molの銅を析出させるには、4molの電子が必要になり、必要な電気量は
4[mol] × 96500 [C/mol] = 386000 [C]
となります。もしも100Aの電流を流せば、
386000 [A/s] / 100[A] = 3860 [s]
となり、およそ64分間電気分解行うことで、目的量の銅を得ることができます。


コメント