この本や記事で分かること
・ニトロメタンの構造が他の分子と違う点は何か
・形式電荷とは何か、なぜ形式電荷が必要なのか
原子の結合数は必ず価電子の数とあっているのか
原子同士は電子を共有することで、結合を生成しています。各原子の最外殻の電子は価電子と呼ばれ、一般的に各原子は価電子の数によって他の原子と結合できる数が決まっています。
水素の価電子は1つのため、他の原子ともう一つの電子を共有することで、安定な結合を形成しています。
炭素であれば4つ、窒素であれば3つの、酸素であれば2つの結合を持つことができます。
しかし、化合物の中には価電子の数よりも多い結合を持っているものや少ない数の結合を持っているものも存在しています。

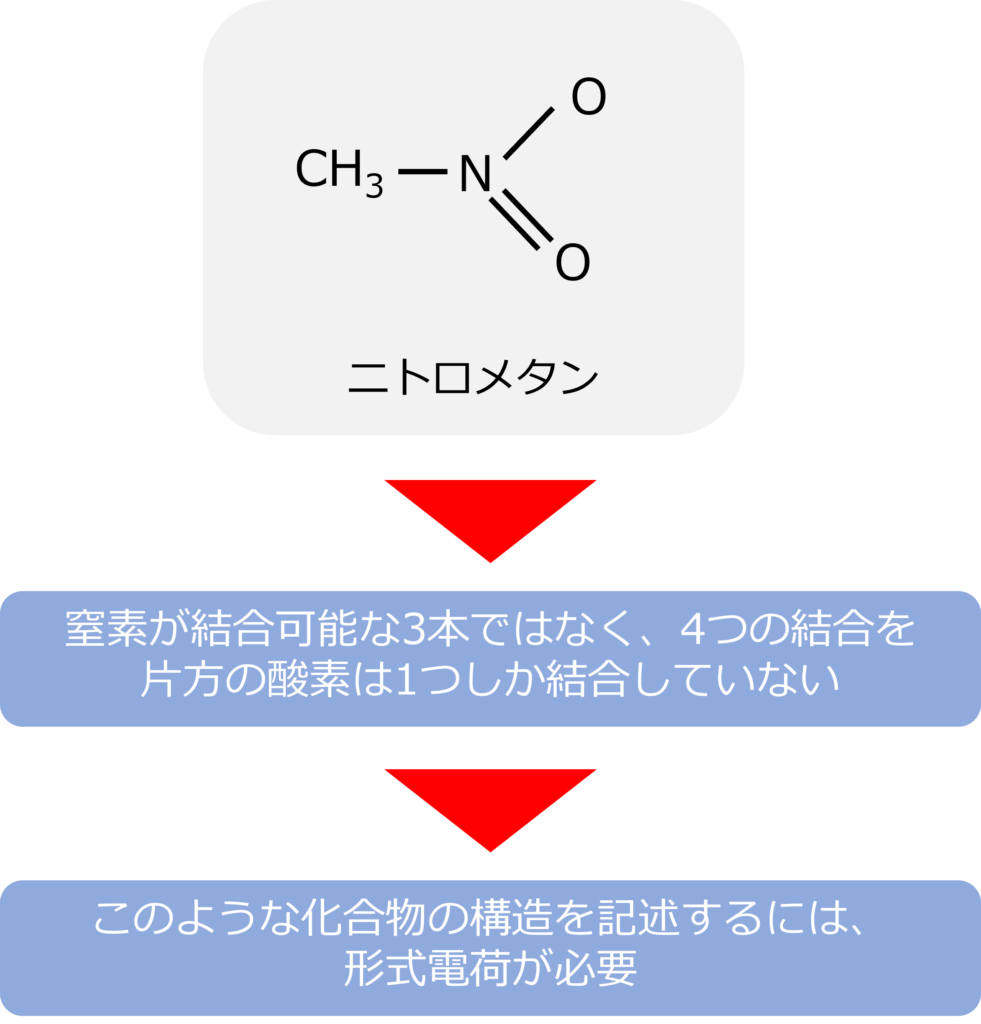
ニトロメタンはどのような構造をしているのか
ニトロメタン(CH3NO2)の窒素原子はメチル基と1つの酸素と単結合を、もう一つの炭素とは二重結合を形成しています。
通常、窒素の結合は3本ですが、ニトロメタンの窒素は4つの結合を有していっています。また、窒素原子と二重結合を形成している酸素は1本しか結合を形成していません。
このような物質の構造を記述する際には、形式電荷という考え方が必要になります。
形式電荷とは何か
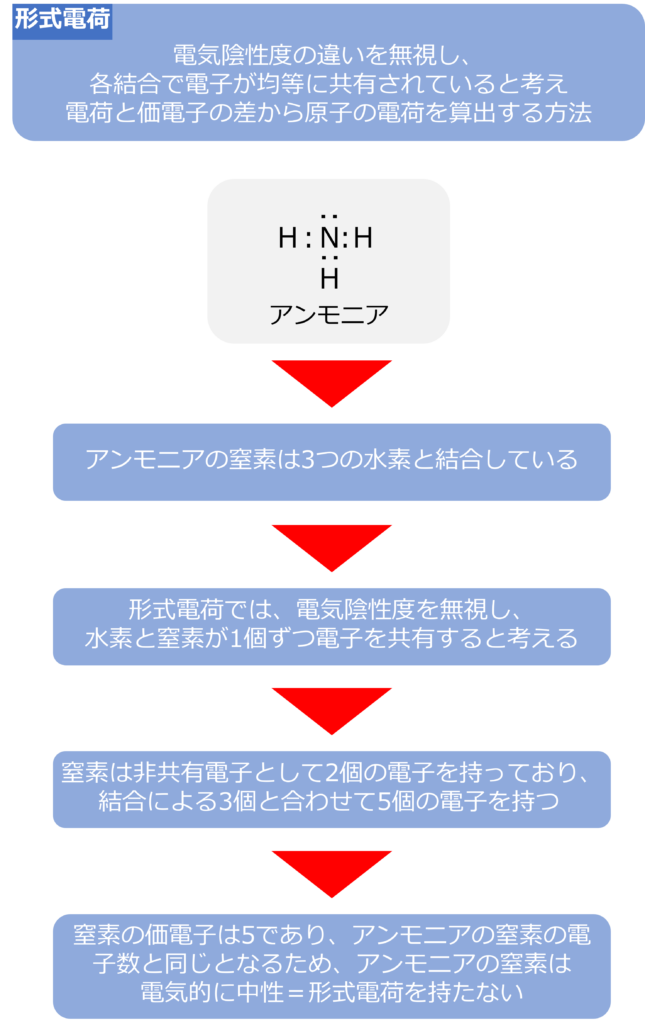
形式電荷は結合間の電気陰性度の違いを無視して、各結合で電子が均等に共有されているものとして、各原子の持っている電荷と価電子の数の差から電荷を形式的に算出する方法です。
窒素原子であれば、5つの価電子をもっており、3つの不対電子と1つの電子対を持っています。
アンモニア(NH3)分子では、3つの不対電子を水素の持つ電子と共有することで、結合を形成しています。
窒素と水素では窒素のほうが電気陰性度が大きく、電子は窒素側に引き付けられていますが。この偏りを無視して、持っている電荷の数を計算します・
窒素原子は3つの水素原子と電子を1つずつ共有し、結合を形成しています。電荷の偏りを無視すれば、各結合に2個の電子があるため、各結合で窒素原子の持つ電荷は1個と、水素が1個となります。結合は3つあるため窒素原子は窒素-水素結合で3つの電子を持っています。
また、窒素原子は2つの電子からなる非共有電子対も持っているため、合計で5つの電子を持っています。
窒素の価電子数は5であり、アンモニアの窒素の持っている電子も5個となるため、アンモニアの窒素は電気的に中性であり、形式電荷を持たないということができます。
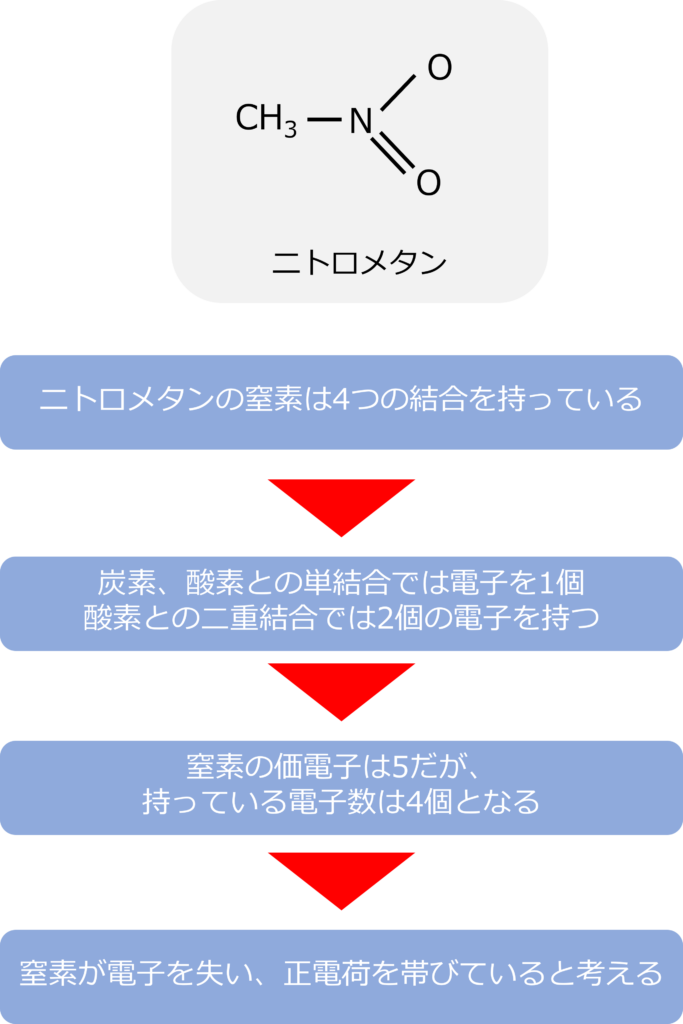
ニトロメタンの窒素はどのような電気的にどんな状態なのか
ニトロメタンの窒素は4つの結合(炭素、酸素との単結合と酸素との二重結合)を有していっています。
炭素、酸素との単結合での窒素の持っている電荷はそれぞれ1つのため、合計2個の電子をもっています。二重結合では酸素と4つの電子を共有しているため、2個の電子を持っています。
窒素の価電子は5にもかかわらず、ニトロメタンの窒素の電荷の合計は4になってしまい、窒素が電子を失い、正電荷を帯びていると考える必要があります。
形式電荷を考慮して、ニトロメタンの構造を記載するとどうなるのか
また、窒素と単結合している酸素は窒素との結合で1個、3つの非共有電子で6個の電荷をもっており、全部で7個の電荷を持っています。
酸素の価電子数は6個であり、電荷の数が価電子を上回っているため窒素と単結合している酸素は負の電荷を帯びていると考えられます。
形式電荷を考慮して、ニトロメタンの構造を記述するときは、正電荷を帯びている窒素に+を単結合している酸素に-を記載します。
ニトロメタンはプラスの形式電荷とマイナスの形式電荷を1つづつもっているため、分子全体では中性ですが、個々の原子には正の電荷と負の電荷を持つものが存在しています。
このような分子は双極性を持つといわれます。形式電荷は電気陰性度による電子の偏りを無視しているため、分子そのものの正確な電荷状態を記述しているわけではありません。
しかし、分子の双極子の性質は分子の化学的性質や有機反応に重要な役割を果たすため、電荷の計算は重要になってきます。



コメント