この本や記事で分かること
・燃料電池とは何か
・燃料電池の利点や構造
・電解質の違いによる電極反応の違い、特徴
燃料電池とは何か
燃料電池は水素(H2)と酸素(O2)を化学反応させることで、電気を発生させる装置です。
電池とはいっても、内部にある化学物質の反応から電気を作り出すのではなく、供給された水素と酸素から直接的に電気エネルギーを生成するものです。
常に、燃料を供給しなければならないという点が欠点でもありますが、供給を続ける限りには電気を生み出すことができるため、発電などにも応用が可能です。
生成物が水のみであるため、非常にクリーンな発電技術として大きな注目を浴びています。

燃料電池はどのような構造をしているのか
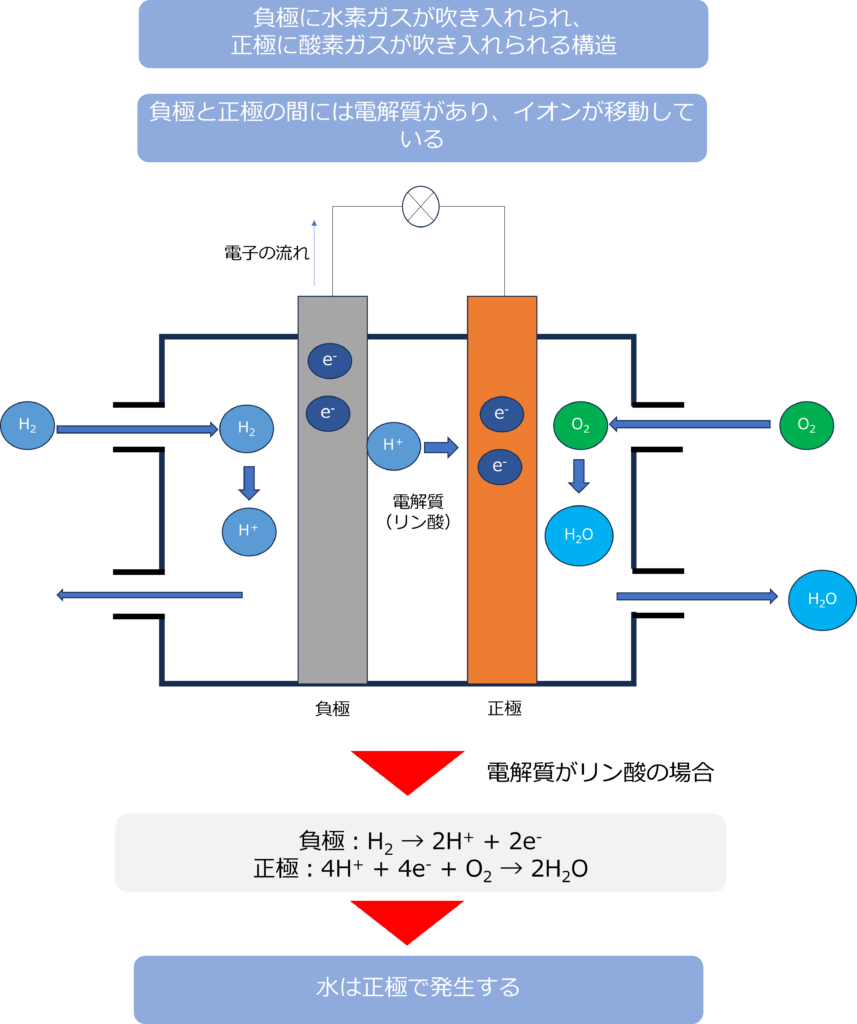
燃料電池の基本的な構造は負極に水素ガスが吹き入れられ、正極に酸素ガスが吹き入れられる構造になっています。
負極は燃焼極、正極は空気極と呼ばれることもあります。
正極室と負極室の間にはイオンの移動を可能にする電解質があり、電解質の種類によって、電極で起こる反応が異なっています。
電解質にリン酸が用いられる場合は、負極では水素がプロトンと電子を放出する反応が、正極ではプロトンが電子、酸素と反応し、水が生成する反応が起きています。
負極:H2 → 2H+ + 2e–
正極:4H+ + 4e– + O2 → 2H2O
全体:2H2 + O2 → 2H2O
電解質膜に固体高分子膜を利用した燃料電池は、固体高分子燃料電池と呼ばれます。リン酸を使用した場合と負極、正極での反応は変わりません。
アルカリ電解質型燃料電池とは何か
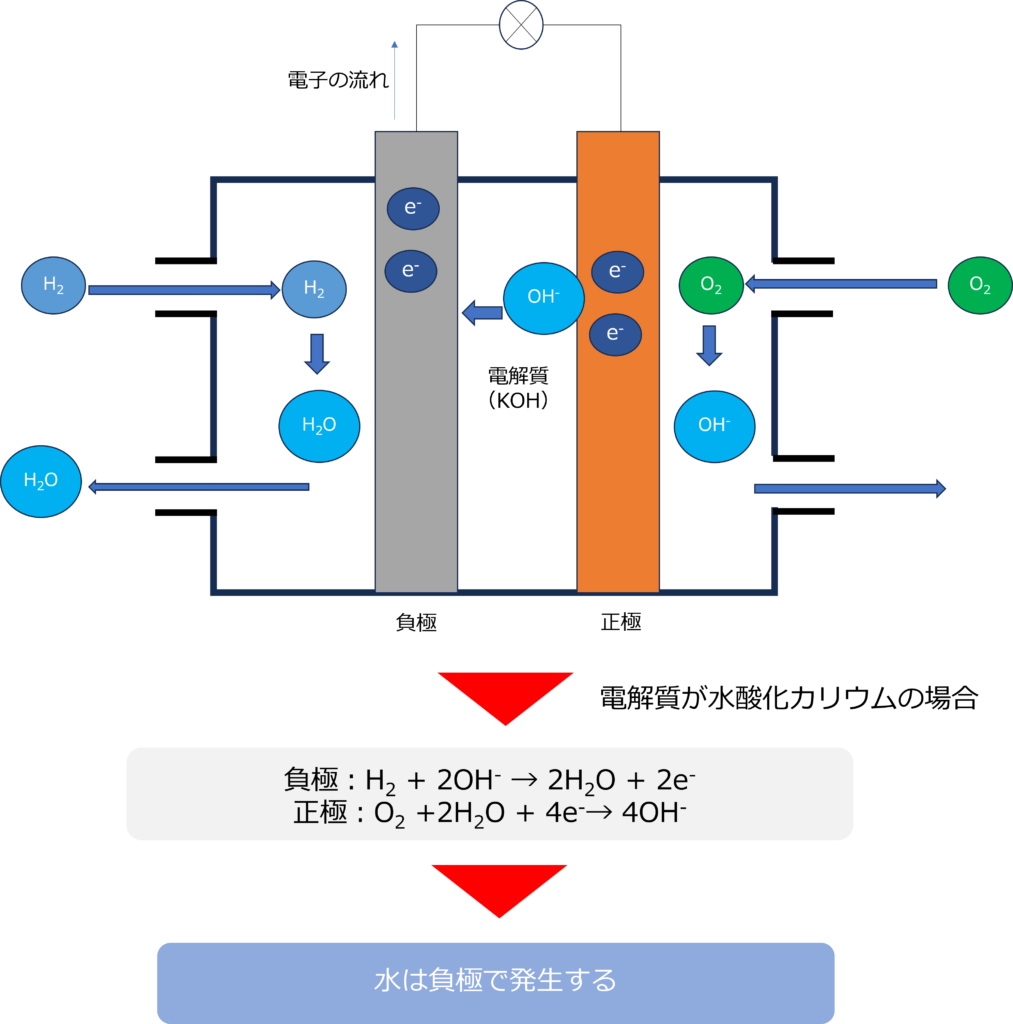
電解質には、水酸化カリウムが利用されることもあります。
水酸化カリウムを使用した場合は、負極では水素と水酸化物イオンから水が生成し、電子を放出する反応が、正極では酸素と水から水酸化物イオンが生成する反応が起きています。
負極:H2 + 2OH– → 2H2O + 2e–
正極:O2 +2H2O + 4e–→ 4OH–
全体:2H2 + O2 → 2H2O
反応全体で見て、水が生成する点は変わりませんが、電解質がリン酸の場合は正極で、水酸化カリウムの場合は、負極で水が発生するという違いがあります。
構造が簡単で、信頼性が高く、宇宙用途でも利用されています。
一方で、酸素に空気を使用すると、電解質のアルカリが二酸化炭素と反応し劣化するため、純度の高い酸素が必要である、水素を炭化水素から合成する場合、炭化水素が残っているとアルカリと反応し、炭酸塩を生じてしまうなどの欠点があり、現在ではあまり研究はなされていません。
燃料電池の課題は何か
排出物が水のみというクリーンさから大きな注目をあびる燃料電池ですが、いくつかの課題もあります。
・触媒
触媒として、白金などを使用する必要があり、コストが高くなってしまいます。白金の使用量を減らす検討や白金を使用しない固体酸化物形燃料電池の開発などが検討されています。
・燃料源の水素
気体であるため、扱にくくコストが高くなってしまいます。また、水素を炭化水素、化石燃料から取り出す場合、二酸化炭素を排出してしまうことも懸念となっています。
・発電効率の低さ
固体高分子燃料電池で30%前後、リン酸型で40%前後と効率の改善が求められています。
固体酸化物形燃料電池とは何か
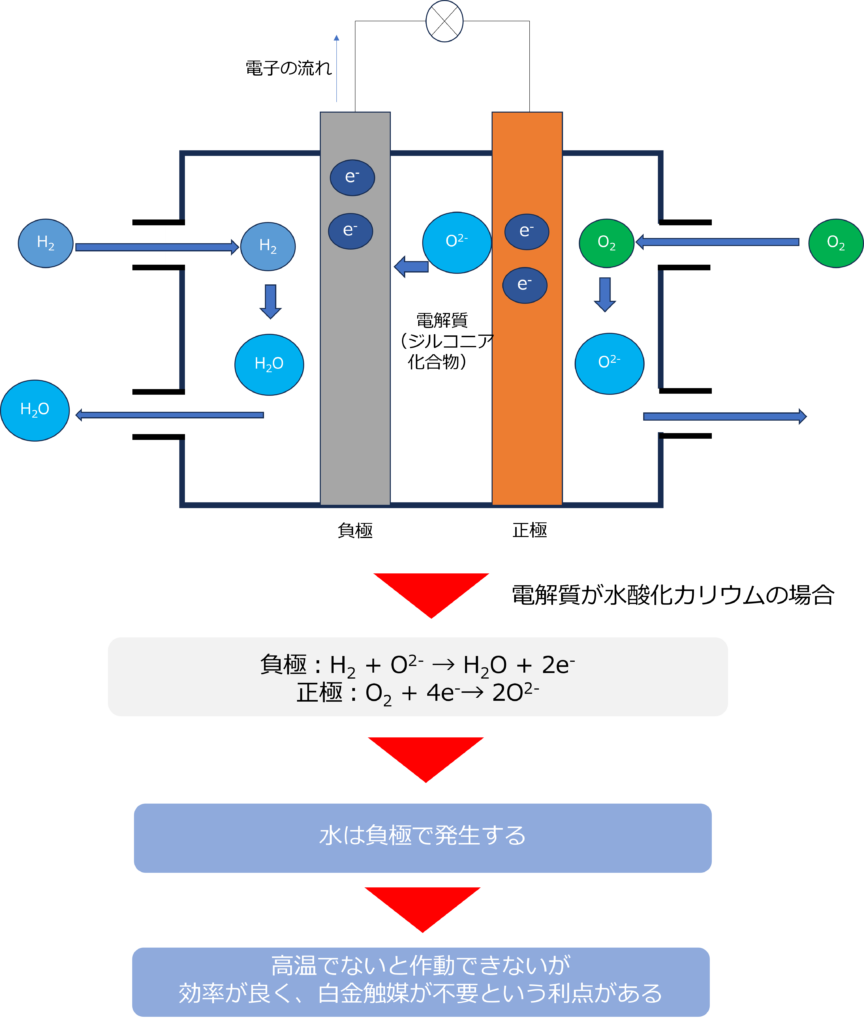
高温の固体電解質を利用した燃料電池であり、プロトンではなく酸化物イオン(O2-)が移動しています。
電解質にはジルコニウム化合物が利用されており、正極、負極では以下のような反応が起きています。
負極:H2 + O2- → H2O + 2e–
正極:O2 + 4e–→ 2O2-
全体:2H2 + O2 → 2H2O
高温での反応が必要なため作動までに時間がかかる反面、以下のような利点があります。
・白金などの高価な触媒が不要である
・水素だけでなく、メタンなどの炭化水素の利用も可能
・発電効率が60%程度高い。排熱も再利用できれば、70%以上と最も効率のよい燃料電池となる


コメント