この本や記事で分かること
・リチウムイオン電池とは何か
・リチウムイオン電池はどんな構造を持っているのか
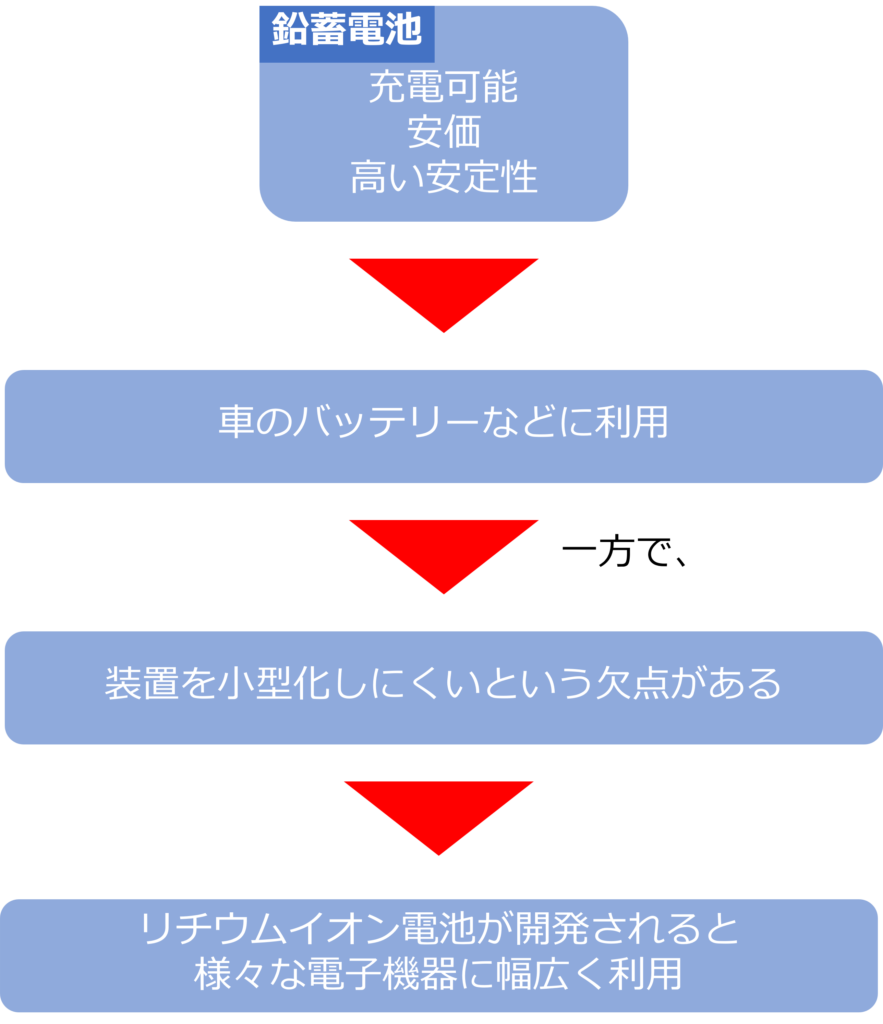
鉛蓄電池の欠点は何か
鉛蓄電池は充電が可能であり、安定性が高く、安価であるなどの利点から車のバッテリーなどに利用されています。
一方で、装置が大型になりやすいという欠点もありました。
そのため小型化しやすいリチウムイオン電池が開発されると、携帯電話をはじめとした電子機器の電池として幅広く利用されるようになっていきます。
リチウムイオン電池での電極や電解質溶液などの改良は続いています。軽量化、効率性UP、耐久性の向上など様々な性能の向上が研究開発されています。
電気自動車のバッテリーとして、自然エネルギーによって発電した電力を蓄電する役割などその利用例は大きく広がっています。
リチウムイオン電池はどんな構造か
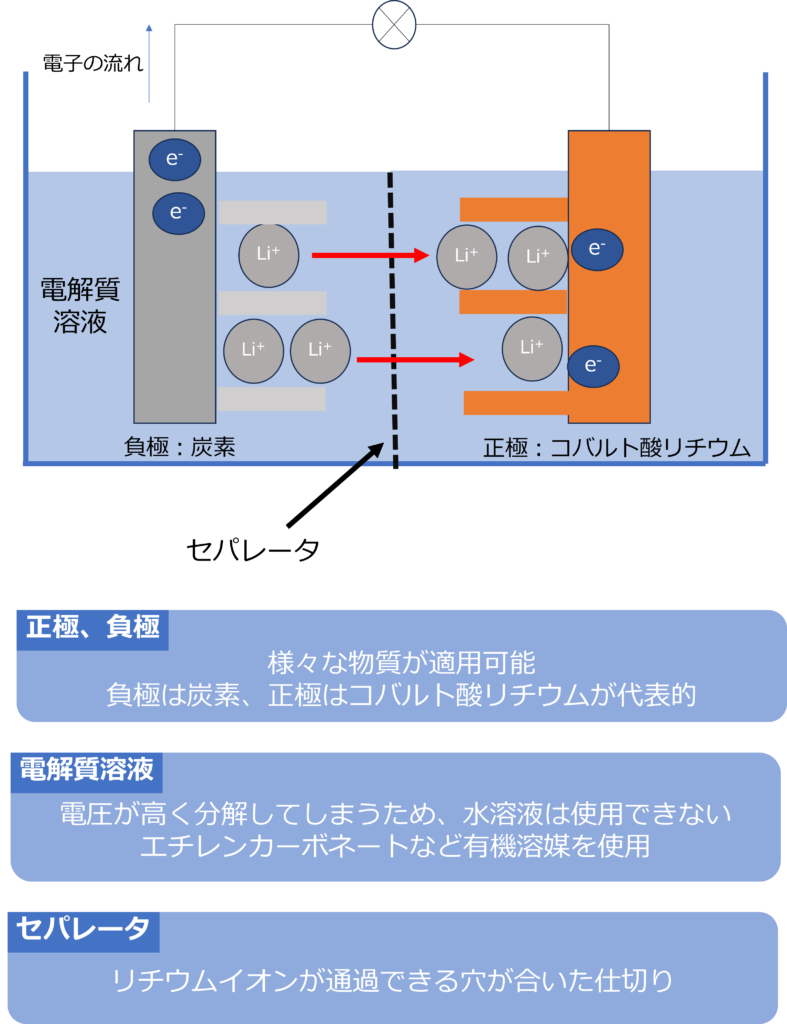
リチウムイオン電池では、Liイオンが移動し、電子の譲受を行うことができれば良いため、電極や電解質溶液には様々な物質が適用可能です。
代表的なものとしては、正極にコバルト酸リチウム(LiCoO2)を、負極に炭素(C)を使用したものがあります。
負極と正極の間には、セパレーターがあり、リチウムイオンが通過できるような穴が開いています。
電解質溶液も様々ですが、高い電圧をで動作するリチウムイオン電池では、水溶液は電気分解してしまうため、使用することができません。
そこで、高電圧でも分解しないエチレンカーボネート、ジエチルカーボネートなどの有機溶媒にLi化合物を溶解させたものが利用されています。
リチウムイオン電池はどんな反応をするのか
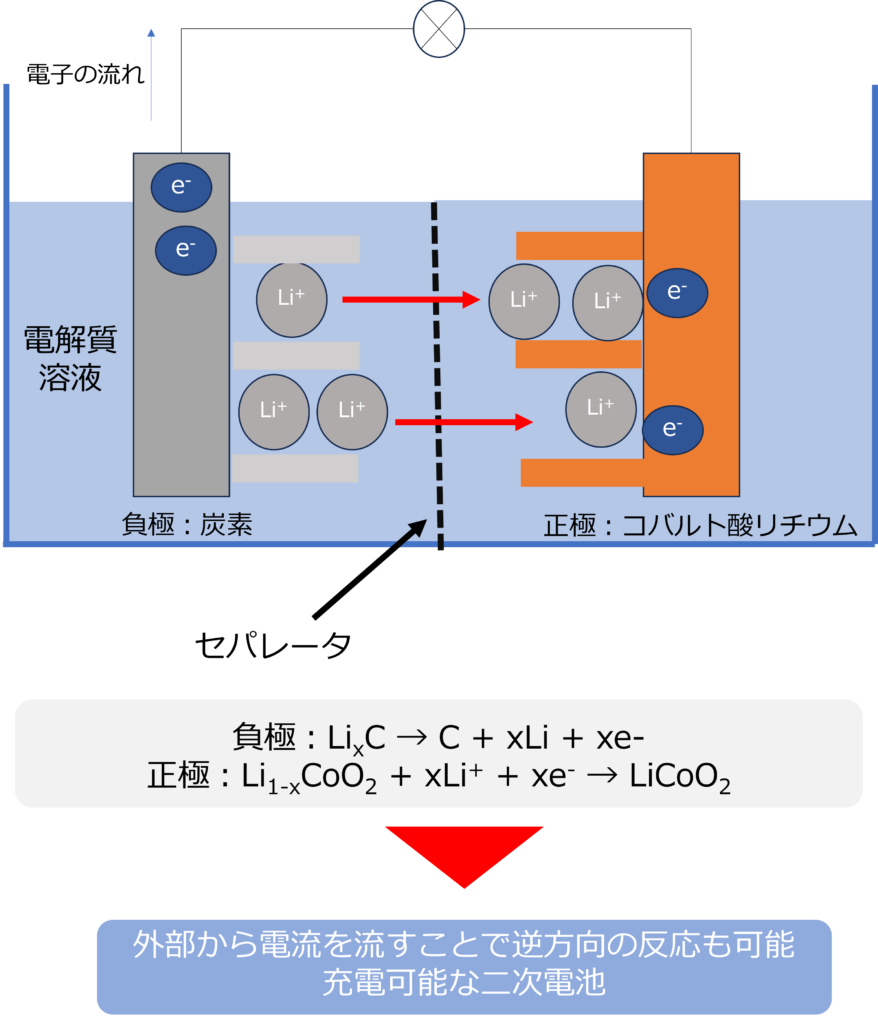
正極、負極それぞれの放電時の反応式は以下の通りです。
負極:LixC → C + xLi + xe-
正極:Li1-xCoO2 + xLi+ + xe– → LiCoO2
負極で発生した電子が、正極でLiを還元し、セパレーターの間をリチウムイオンが通過することで、電流が流れるようになっています。
また、それぞれの反応が逆方向にも反応可能であるため、順電が可能な二次電池となっています。
リチウムイオン電池の電極はなぜ、リチウムイオンを保持できるのか
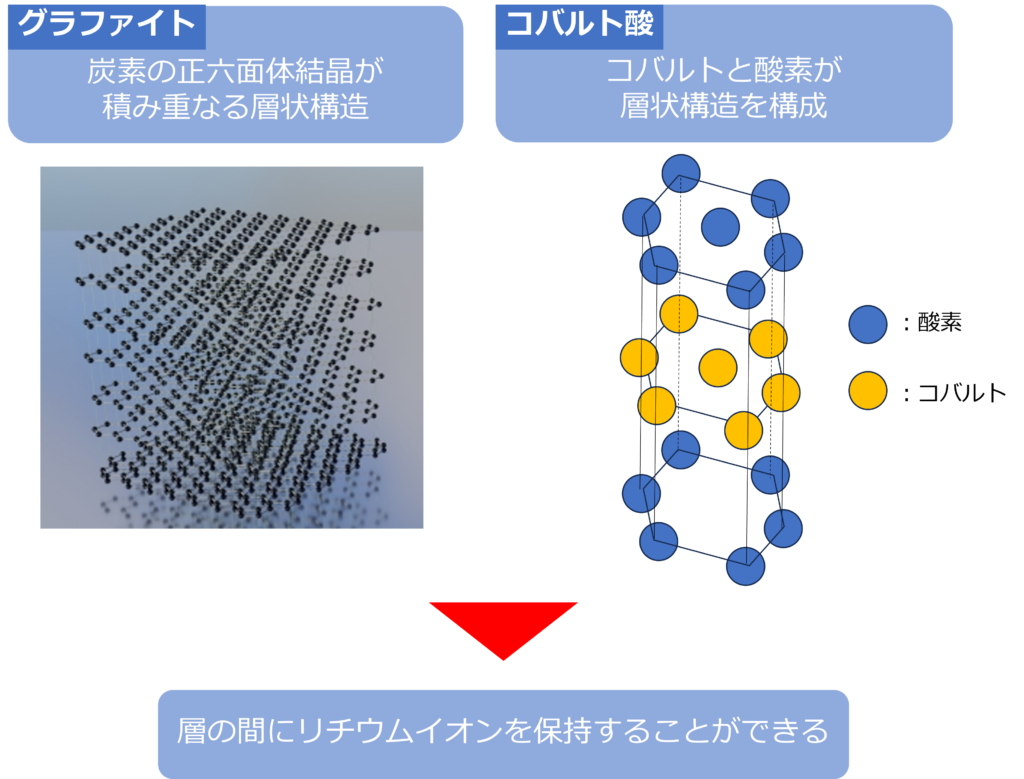
リチウムイオン電池では、リチウムイオンが電極を電極内部に保持することができます。
負極の炭素はグラファイトと呼ばれるもので、正六面体からなる平面構造が層状に積み重なってできています。
この層状構造があることで、リチウムイオンを保持したり、放出したりといったことが可能になっています。
正極のコバルト酸リチウムも同じように、層状の結晶構造をもっているため、層間にリチウムイオンを保持することが可能になっています。
リチウムイオン電池の劣化を防ぐにはどうすれば良いのか
充電を続け、容量がいっぱいになった状態でさらに充電を行うことを過充電と呼びます。
過充電を続けてしまうと、正極から許容量以上のリチウムイオンが放出されてしまい、正極が劣化しています。
また、劣化した正極で酸素が発生し、電解質溶液が酸化分解されガスが発生し、バッテリーが膨れたり、爆発することもあります。
近年の電子機器では、過充電を避けるために、ある程度充電されると充電速度を落としたり、100%充電されたところで電流が流れないようにするなどの工夫がなされています。
それでも、電解質溶液の分解などバッテリーの劣化そのものが起きないようにすることはできません。電解質溶液の分解も化学反応であり、温度が高い状態では発生しやすくなります。
過充電を避けるために、充電速度を落とた状態や、極端に充電が少ないところで充電を行うと熱が発生しやすくなるため、20~80%の間で充電と放電(機器の使用)を行うことでバッテリーの劣化を防ぎやすくなります。
また、充電と放電どちらも熱が発生するため、充電時に機器を利用することを避けることや高温での使用を避けることも効果的です。



コメント