この本や記事で分かること
・中和滴定とは何か
・どのように中和滴定を行うのか
・指示薬とは何か
酸や塩基の濃度はどのように求めるのか
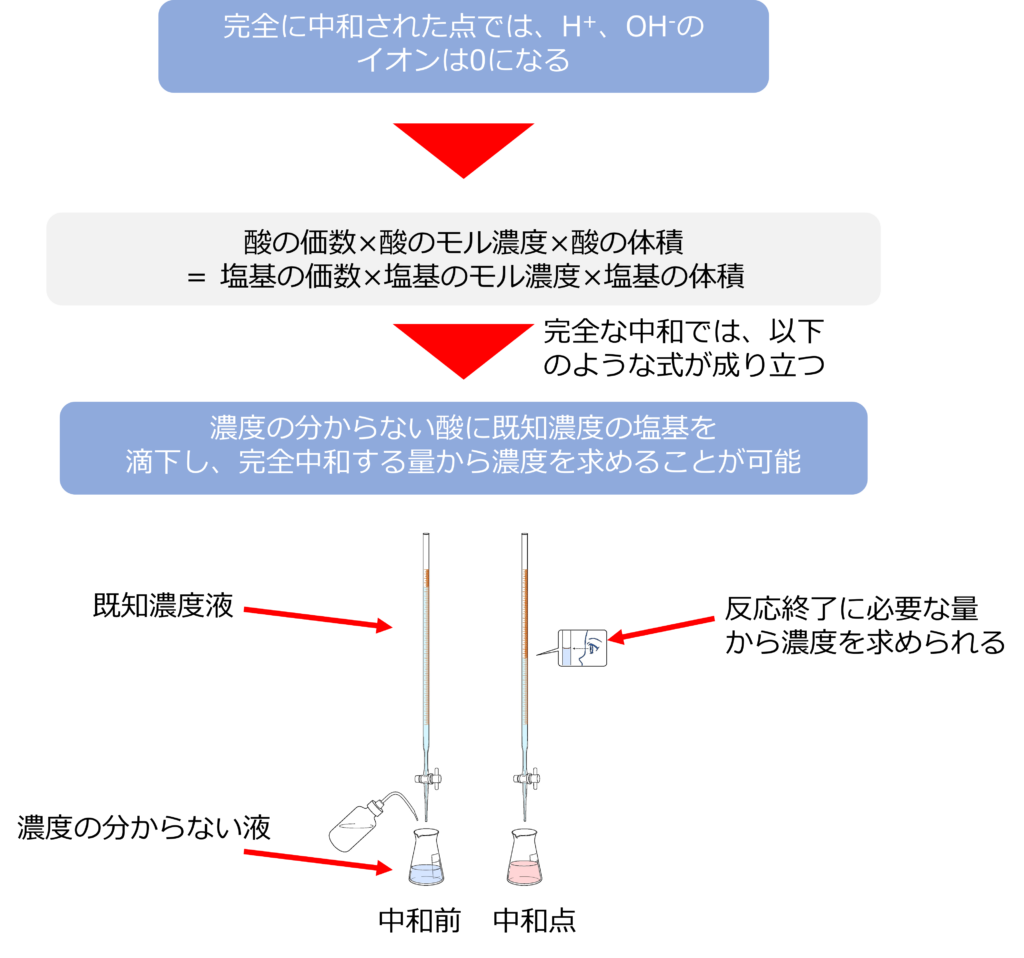
酸や塩基の濃度がどれくらいかを測定する際には、中和反応が利用されます。
酸と塩基はH+とOH–による中和反応で水を生じ、中和されることで、それぞれのイオンが減っていき完全に中和することで、0になります。
酸と塩基が完全に中和するときには以下のような式が成り立ちます。
酸の価数×酸のモル濃度×酸の体積 = 塩基の価数×塩基のモル濃度×塩基の体積
そのため、濃度の分からない酸に濃度の分かっている塩基を滴下し、中性となるまでに必要であった塩基の量から酸の濃度を求めることができます。
中和滴定の際にpHはどのように変化するのか
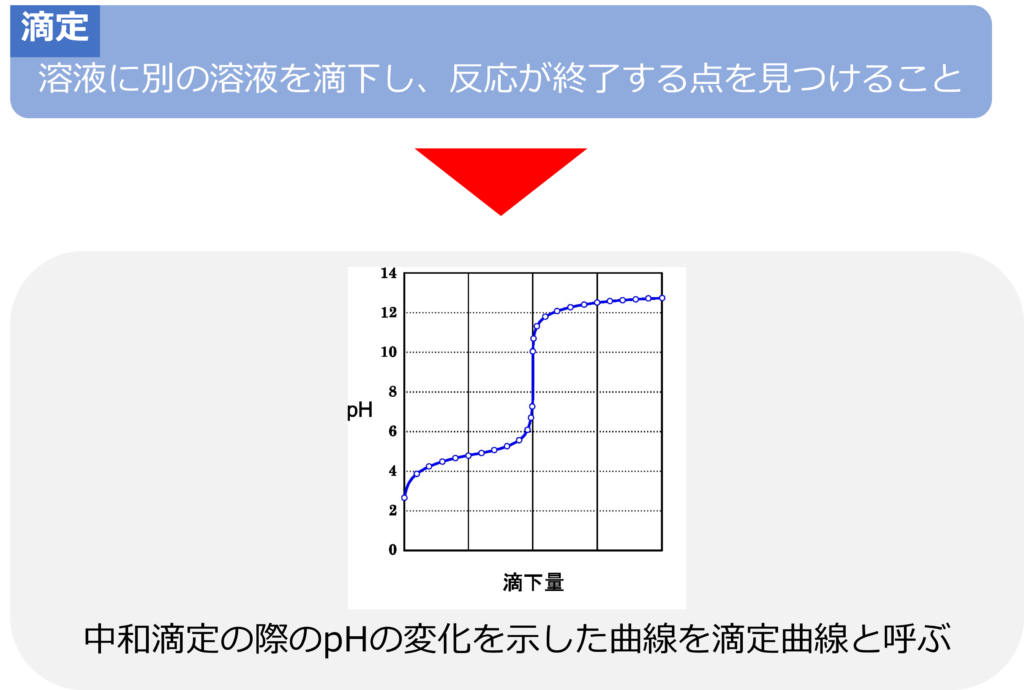
ある溶液に別の溶液を滴下し、反応が終了する点を見つけることで溶液の量を測定する方法は滴定と呼ばれ、中和反応を利用する際には、中和滴定と呼ばれます。
中和滴定を行った時のpHの変化を示した曲線を滴定曲線と呼びます。
強酸に強塩基の水溶液を加えるとき、滴定量が少ないときはpHの変化はあまり大きくありませんが、中性付近に近づくとpHが大きく変化します。
塩酸に水酸化ナトリウムを滴下するとpHはどのように変化するのか
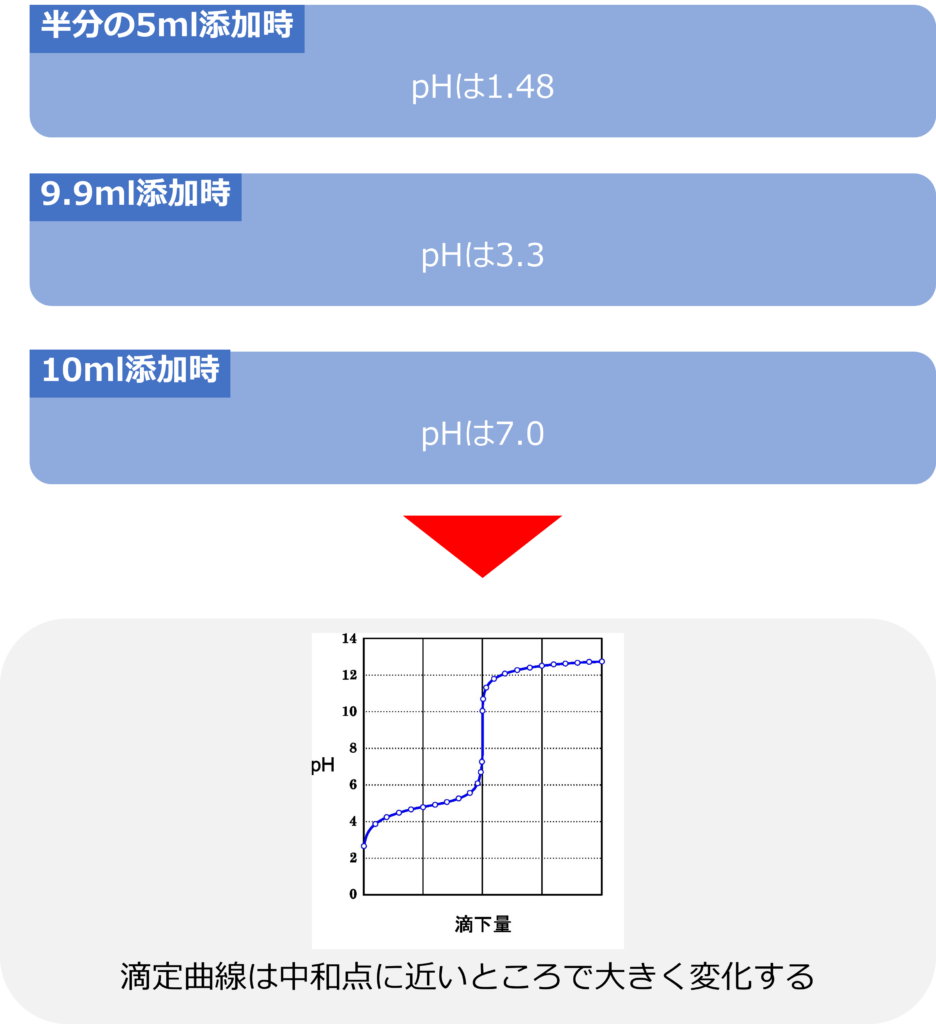
例えば、0.1mol/Lの塩酸10mlを0.1mol/Lの水酸化ナトリウム水溶液で中和するときに必要な水酸化ナトリウム水溶液は10mlとなります。
水酸化ナトリウム滴下前の[H+]=0.1mol/Lとなり、pHは1.0となります。塩酸中の水素イオンの量は0.1mol/L × 0.01 L = 0.001mol。
また、10mlの添加で完全に中和され、pHは7となります。
水酸化ナトリウムを半分の5ml添加したとき水酸化物イオンは0.1 × 5/1000 = 0.0005 molとなり、
中和反応後に残る水素イオンの量は0.001-0.005 = 0.0005 molとなります。
溶液の量は塩酸10 mlと水酸化ナトリウム溶液5 mlで15 ml= 0.015Lとなるため反応後の水素イオン濃度は
[H+]= 0.0005/0.015 = 0.033 [mol/L]
となり
pH=-Log10 (0.033)= 1.48
となります。完全中和に必要な量の半分を滴下しても、まだほとんどpHは変化していないことが分かります。

中和点付近でpHはどのように変化するのか
水酸化ナトリウムを9.9ml添加したときは
水酸化物イオンの量は
0.1 × 9.9/1000 = 0.00099mol
となり、中和反応後に残る水素イオンの量は
0.001-0.00099 = 0.00001molとなります。
溶液の量は塩酸10 mlと水酸化ナトリウム溶液9.9 mlで 19.9 ml= 0.0199Lとなるため反応後の水素イオン濃度は
[H+]= 0.00001/0.0199 = 0.0005 [mol/L]
となり
pH=-Log10 (0.005)= 3.3
となっており、滴定曲線は中和点に近いところで、大きな変化をすることが分かります。この急激な変化はpHジャンプと呼ばれます。
中和滴定の終点はどのように判断するのか
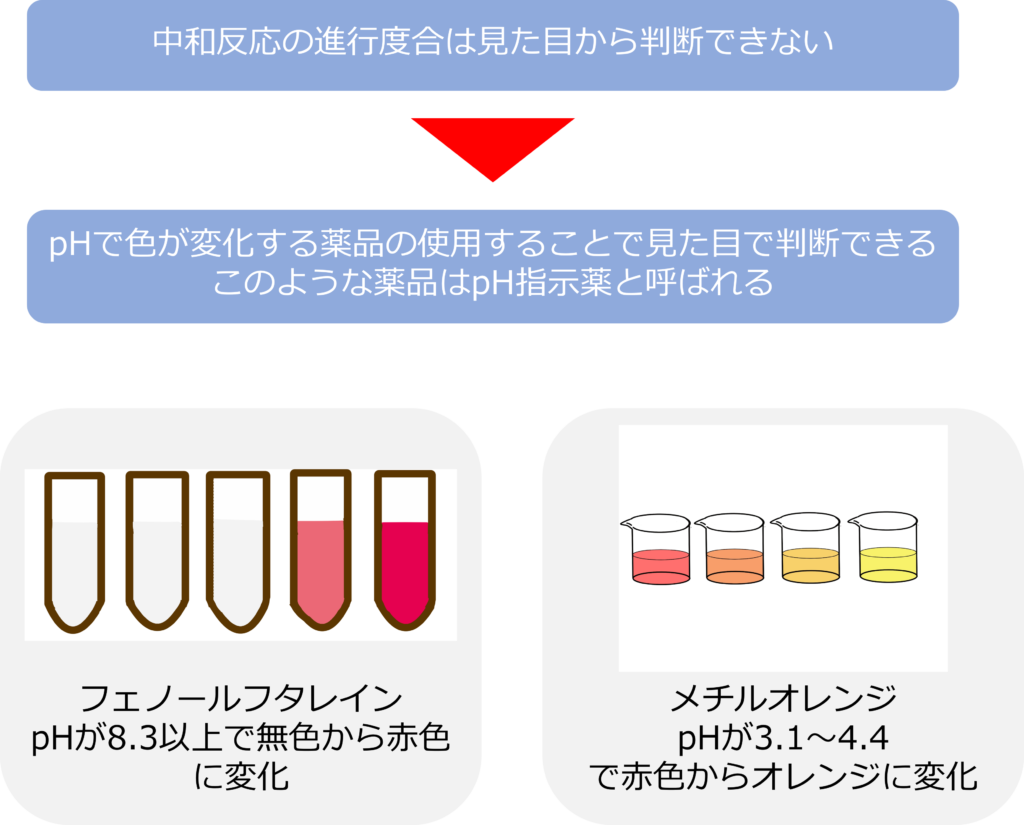
中和反応がどれくらい進行しているのかは、見た目から判断できませんが、溶液のpHによって、色が変化する薬品を用いることで見た目から判断をすることが可能です。
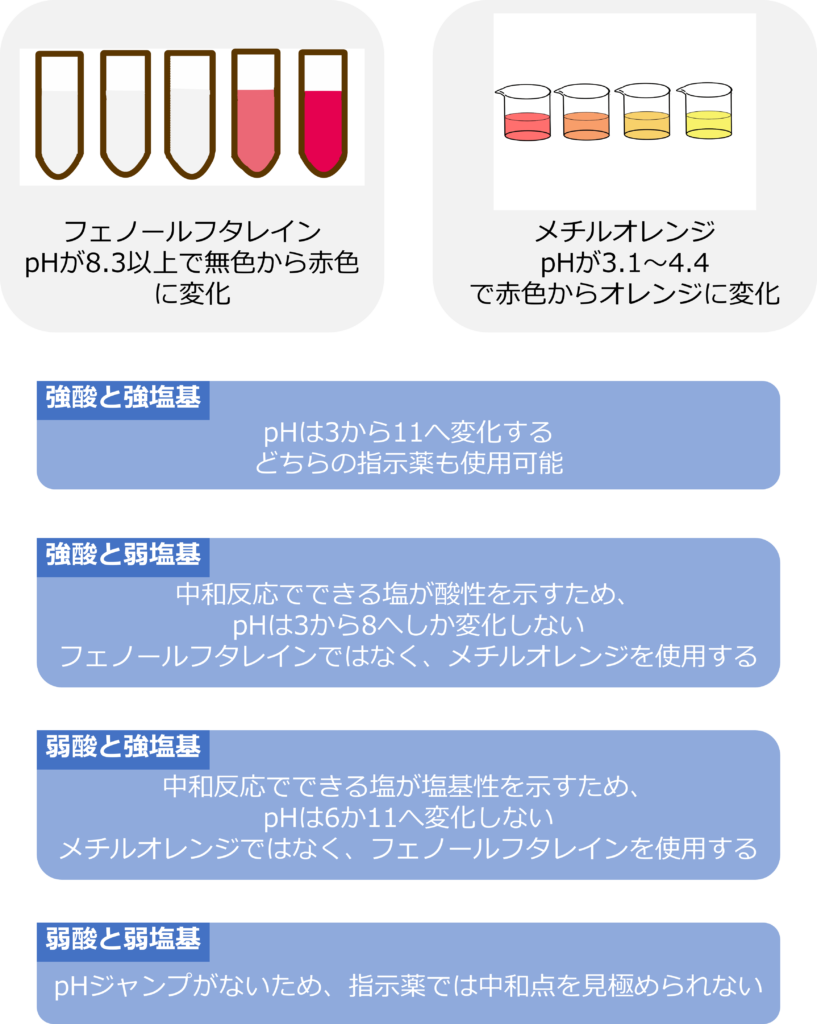
このような薬品は指示薬と呼ばれ、中和反応の指示薬としては、フェノールフタレインやメチルオレンジがよく使用されます。
フェノールフタレインはpHが8.3以上になると色が無色から赤色に変化します。メチルオレンジはpH3.1~4.4で赤からオレンジに変化します。
pH指示薬はどのように使い分けるのか
強酸を強塩基で滴定する場合は、中和点付近でpHジャンプが起きています。pHジャンプが起きるとpHは約3から11へと変化するため、どちらの指示薬を利用しても、色の変化によって、中和点を判断することが可能です。
しかし、強酸を弱塩基で中和する場合、pHジャンプは強塩基で中和した時と比較すると、小さくなり、およそ3から8へと変化します。
これは強酸と弱塩基の中和反応でできる塩が酸性を示すため、中和点のpHが7よりも高くなるためです。
中和点でのpHジャンプ後もpHが8しかないため、フェノールフタレインの変色域に届かないため、フェノールフタレインではなくメチルオレンジを使う必要があります。
また、弱酸を強塩基で滴定する場合はpHジャンプは6から11への変化となります。
これも塩が塩基性を示すためであり、この場合メチルオレンジの変色は中和点よりも少ない添加量の時点から始まってしまうため、指示薬として使用することはできません。
弱酸と弱塩基の場合は、そもそもpHジャンプを示すことがないため、どちらの指示薬を使用しても中和点を見極めることはできません。


コメント