この本や記事で分かること
・酸化還元とは何か
・電子の受け渡しはどのように起こるのか
・酸化数とは何か
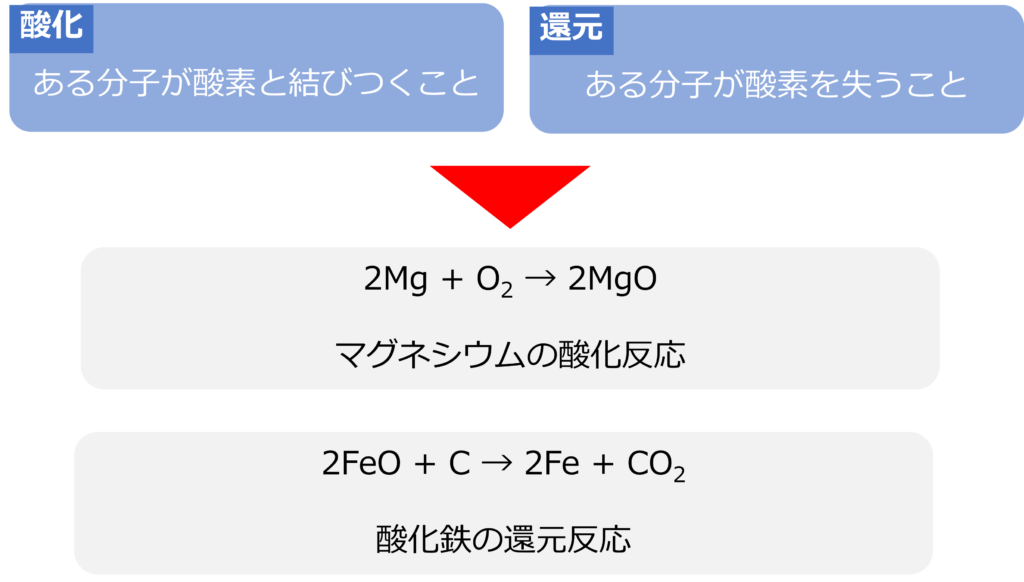
酸化、還元とは何か
ある物質が酸素と結びつくことを酸化、酸素を失うことを還元と呼びます。
マグネシウムを燃焼させると酸素と結合し、酸化マグネシウムができる反応はマグネシウムの酸化反応です。
2Mg + O2 → 2MgO
また、酸化鉄と炭素から鉄と二酸化炭素ができる反応は酸化鉄の還元反応となります。
2FeO + C → 2Fe + CO2
マグネシウムの燃焼を酸化還元反応としてみるとどうなるのか
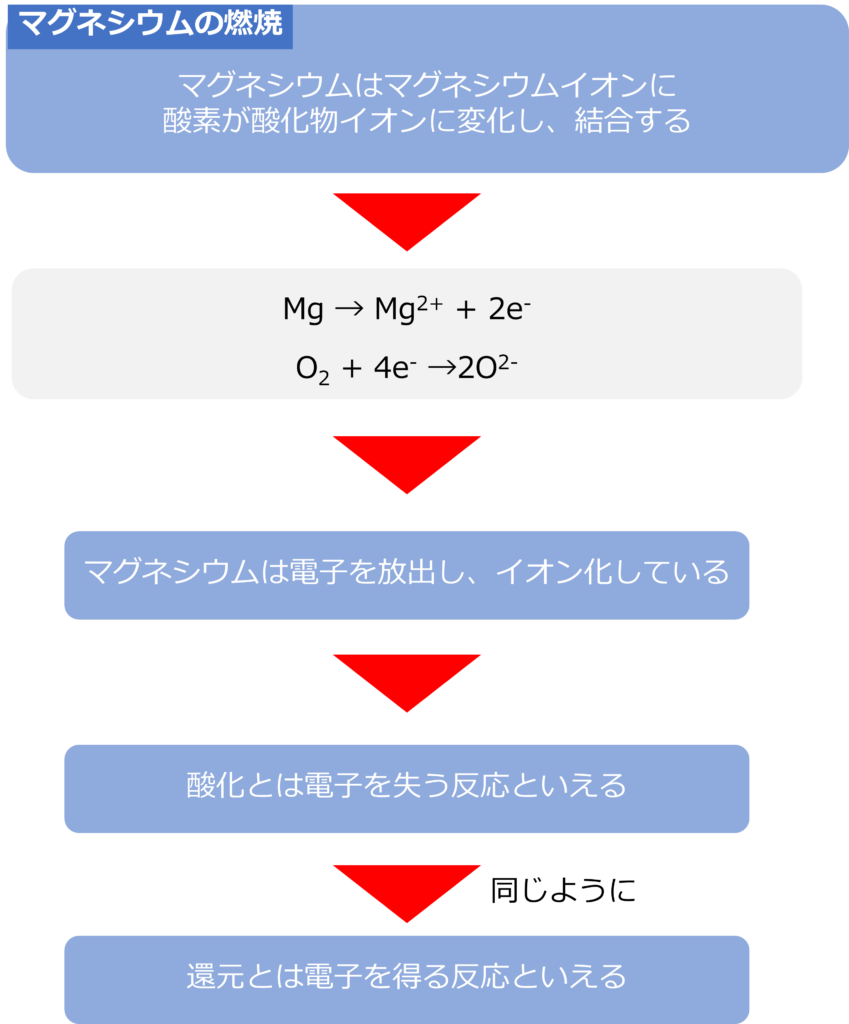
マグネシウムの燃焼を電子の受け渡しで考えると以下のようになります。
酸化マグネシウムはマグネシウムイオンと酸化物イオンからなるイオン結晶です。マグネシウムはマグネシウムイオンに、酸素は酸化物イオンに変化しています。この変化を電子(e–)を用いて表すと以下のようになります。
Mg → Mg2+ + 2e–
O2 + 4e– →2O2-
このように、マグネシウムは燃焼する際に、電子を放出し、イオン化しています。このように酸化とは電子を失う反応と言い換えることができます。
同じように還元は電子を得る反応と言い換えることができます。電子が放出されるとき、その失った電子は受け取る原子が存在しています。酸化と還元は必ず対になって同時に発生します。
マグネシウムの酸化反応は酸素の還元反応と酸化鉄の還元反応は炭素の酸化反応とみることもできます。
酸素を伴わない反応も酸化還元反応と捉えられるのか
酸化還元反応を電子の放出と授受と考えることで、酸化還元反応は酸素を伴わない反応へ拡張することができます。
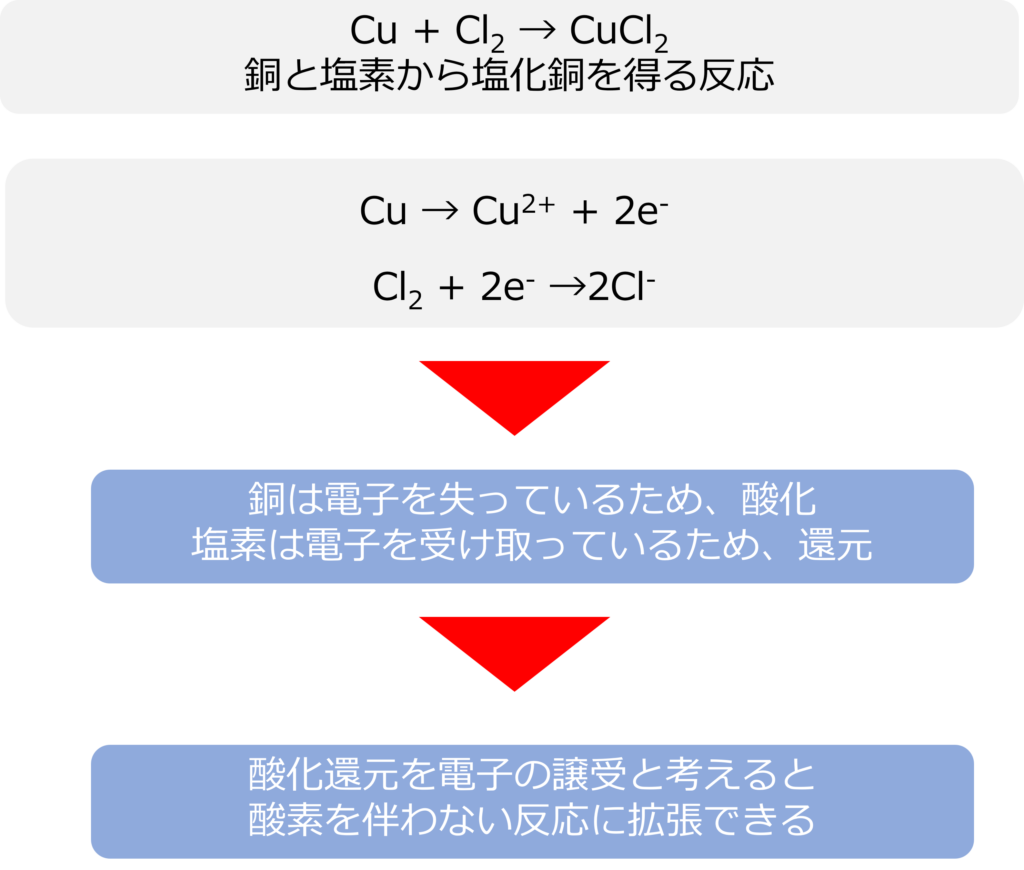
銅と塩素から塩化銅を得る反応(Cu + Cl2 → CuCl2)は銅が銅イオンになり、塩素が塩化物イオンになることで生成しています。
Cu → Cu2+ + 2e–
Cl2 + 2e– →2Cl–
銅は電子を失っているため、酸化、塩素は電子を受け取っているため還元ととらえることができます。
酸化、還元を酸素のやり取りだけなく、電子のやり取りに拡大することで、より幅広い反応に拡張することが可能です。
酸化数とは何か
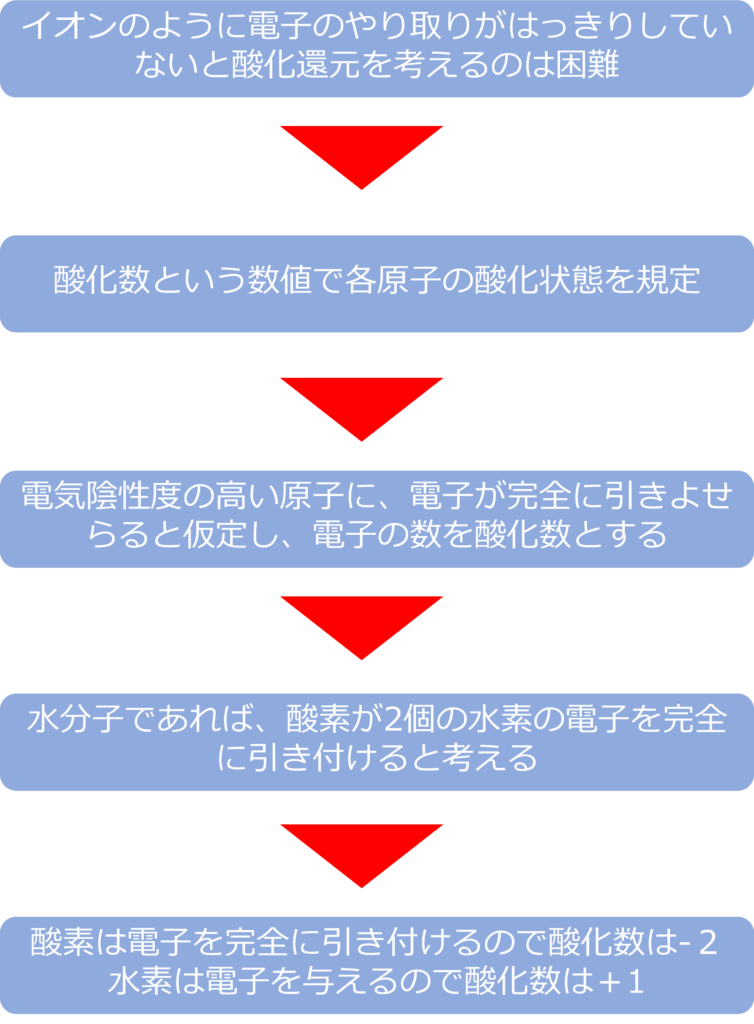
イオンのように電子のやり取りがはっきりとしているものであれば、酸化還元の定義は容易ですが、共有結合のように電子を共有している場合、酸化還元を直接考えることは難しくなります。
そのため、酸化数という数値で各原子の酸化状態を規定することで、酸化還元反応を考えることがあります。
共有結合でも異なる原子の結合であれば、電気陰性度に差異が生じ、電子はどちらかの原子に引き付けられることとなります。
このとき、イオン結合のように、電気陰性度の高い原子に完全に電子が引き付けられたと仮定し、その際にそれぞれの電子の数を酸化数として考えます。
例えば、水分子(H2O)であれば、酸素の方が水素よりも電気陰性度が高く電子は酸素の方に引き寄せられています。
本来は酸素の方に完全に電子が引き寄せられているわけではありませんが、酸化数を考える時には
は酸素側に共有している電子が完全にひきつけられているとします。
この時、酸素原子は2個の水素原子から1個ずつ電子をひきつけるため、酸化数は-2となり水素原子は電子を1個酸素に与えているため、+1となります。
酸化数にはどんなルールがあるのか
酸化数は以下のようなルールをもっています。
・単体の原子の酸化数は0となる。酸素分子の酸素原子の酸化数は0
・イオンの酸化数は、イオンの価数になる
Cu2+の酸化数は+2、SO42-では、Sが+6 Oが-2×4=-8となる
・化合物の酸素原子の酸化数は-2、水素原子は+1とする
・化合物全体の酸化数の和は0
CuOの場合、銅の酸化数は+2、酸素が-2で全体では0になる
反応によって、酸化数が増加した原子は酸化され、減少した物質は還元されたと判断できます。
酸化銅の還元反応の酸化数はどのようになっているのか
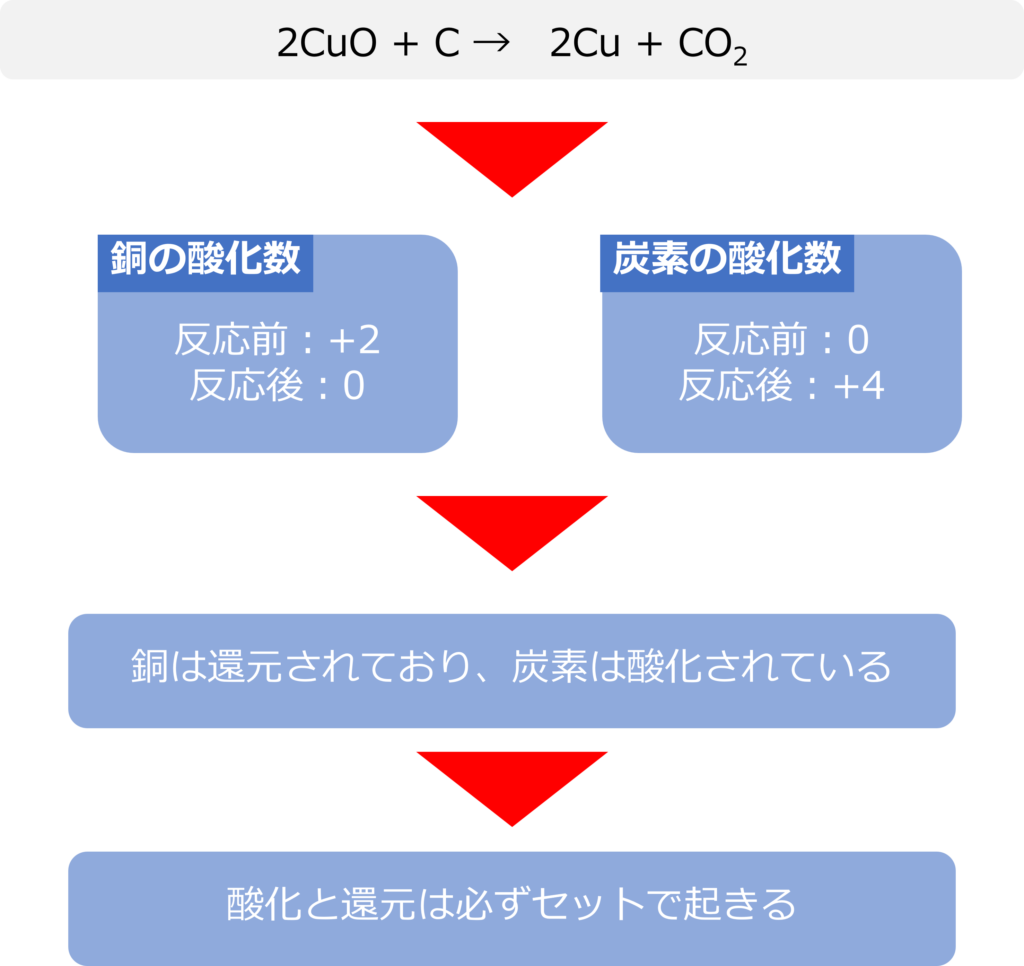
たとえば、酸化銅と炭素から銅と二酸化炭素ができる反応では
2CuO + C → 2Cu + CO2
Cuは反応前の酸化数+2から0に変化したため還元されており、Cは反応前の酸化数0から+4に変化したため酸化されたことがわかります。
物質が酸化されるときには、必ず還元される物質も存在しています。
このような反応を酸化還元反応とよび
・相手を酸化させ自分は還元する物質を酸化剤
・相手を還元させ自分は酸化する物質を還元剤
と呼びます。


コメント