この本や記事で分かること
・二次電池とは何か
・なぜ、ダニエル電池やボルタ電池は充電できないのか
・充電のできる鉛蓄電池の特徴
二次電池とは何か
マンガン電池やアルカリ電池は、使い切ってしまい放電した状態になると、充電して再利用することはできません。
このような電池は一次電池と呼ばれ、使い切りの電池となります。
一方で、使い切った後も充電することで再利用することのできる電池は、二次電池、充電池、蓄電池などと呼ばれています。
代表的な二次電池には、鉛蓄電池やリチウムイオン電池などが挙げられます。

鉛蓄電池はどのような電池なのか
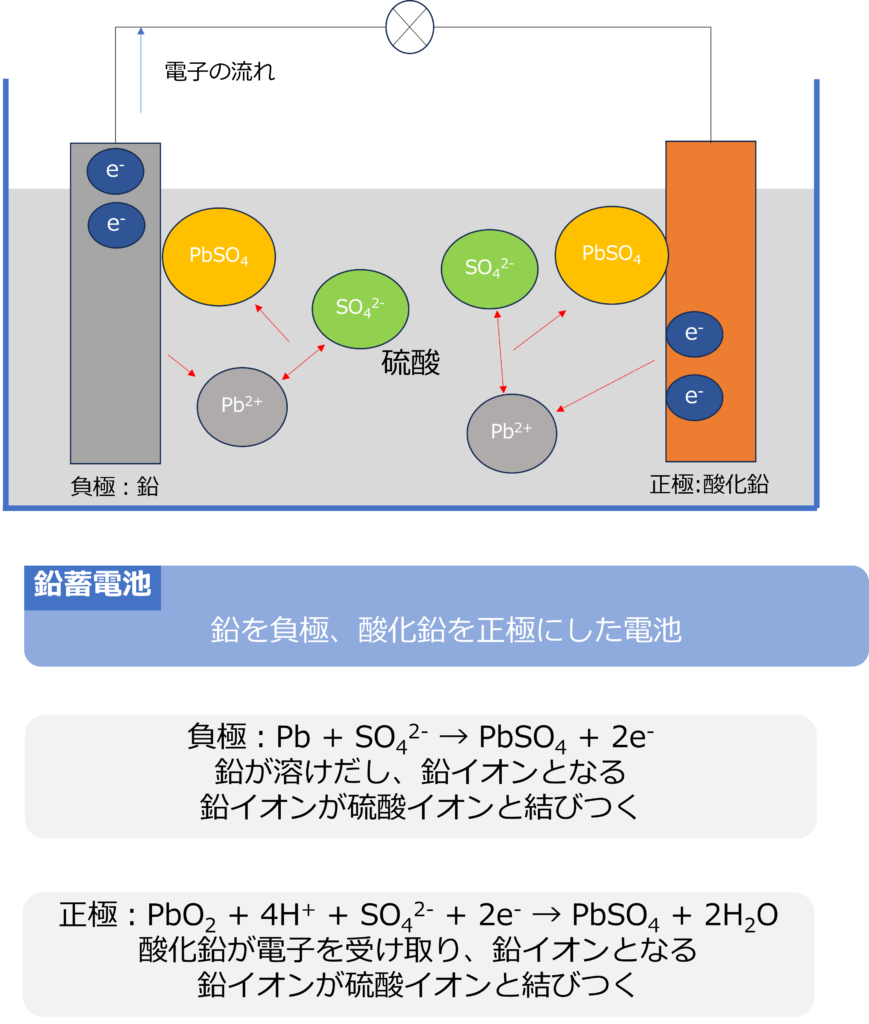
鉛蓄電池は硫酸中に、負極である鉛(Pb)と正極となる酸化鉛(PbO2)からなる電池です。
電池式は以下の通りです。
(-) Pb | H2SO4 | PbO2 (+)
負極である鉛(Pb)は硫酸中に溶けだし、鉛イオンになりますが、硫酸イオンとむずびつき、硫酸鉛となり負極表面に付着する反応が発生します。
負極:Pb + SO42- → PbSO4 + 2e–
正極でも、酸化鉛(PbO2)が電子を受け取り、鉛イオンになりますが、すぐに硫酸イオンと結びつき、硫酸鉛となり、正極表面に付着する反応が発生します。
正極:PbO2 + 4H+ + SO42- + 2e– → PbSO4 + 2H2O
電極全体では、以下のような反応となります。
Pb + PbO2 + 2H2SO4→ 2PbSO4 + 2H2O
ボルタ電池が充電器ないのはなぜか
二次電池は充電を行うことで、失った電力を取り戻すことのできる電池のことです。充電とは放電時とは逆向きに外部から電流を流すことで、正極と負極の状態を放電前に戻すことになります。
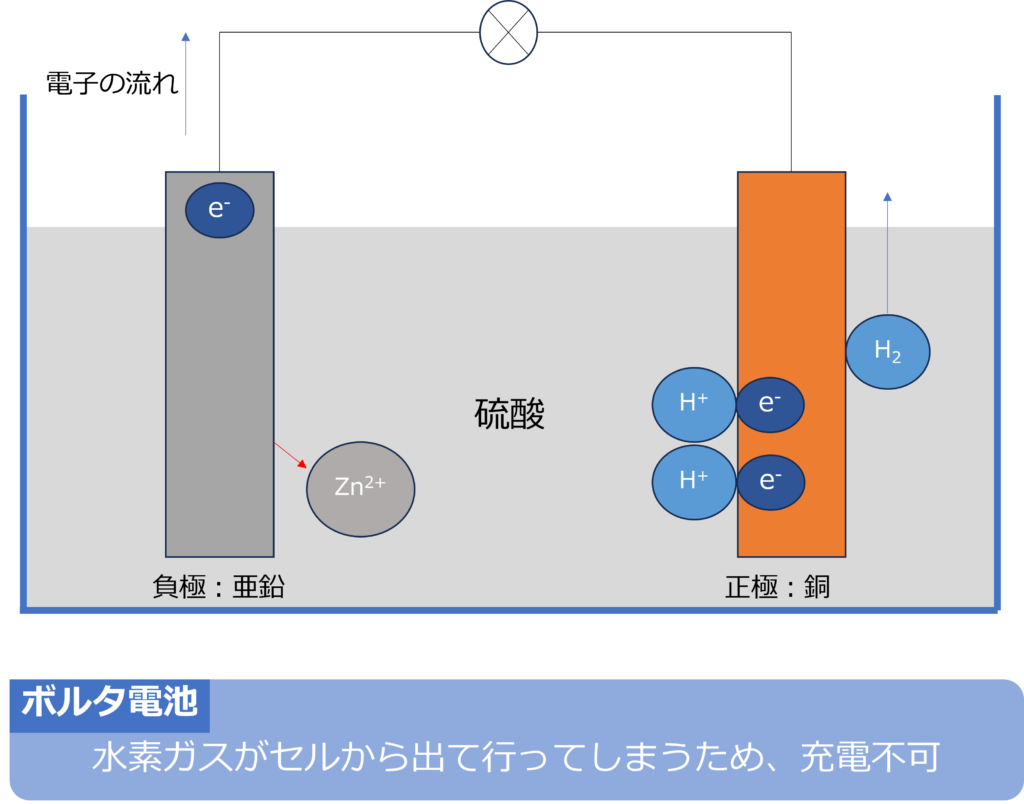
ボルタ電池の正極、負極でのそれぞれの反応は以下の通りです。
負極:Zn → Zn2+ + 2e-
正極:2H+ + 2e– → H2
ボルタ電池では、水素イオンはガスとしてセルから出て行ってしまうため、逆向きの反応を発生させても、元の状態にすることができないため、充電することはできません。
ダニエル電池はなぜ充電できないのか
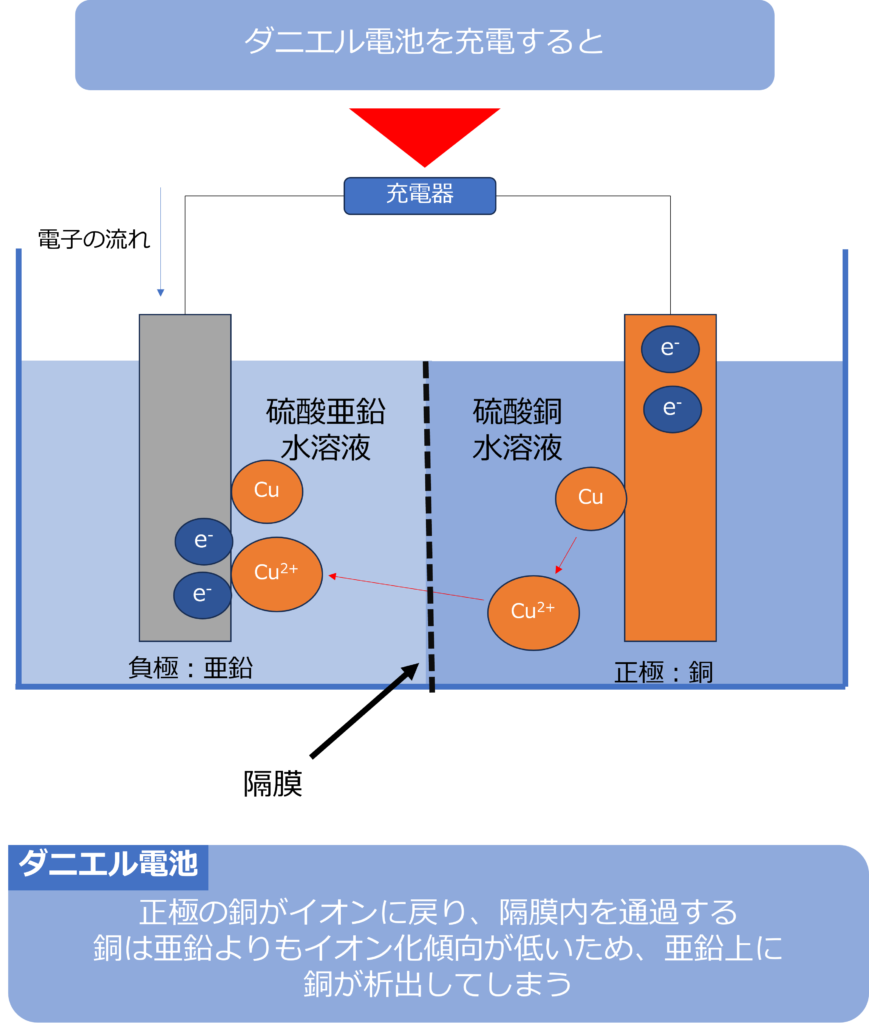
ダニエル電池では以下のような反応が起きています。
負極:Zn → Zn2+ + 2e-
正極:Cu2+ + 2e– → Cu
逆反応を起こし、正極に析出した銅をイオンに戻し、亜鉛イオンを還元して、亜鉛として負極に析出させれば、充電ができそうに思えます。
しかし、逆反応を起こすと、負極室と正極室を分けていた隔膜の中をCu2+が隔膜の中を通り、負極室に移動してしまいます。
銅は亜鉛よりも、イオン化傾向が低く、還元されやすいため、負極の亜鉛に銅が析出してしまいます。逆反応を行っても、電極を元の状態に戻すことができないため、ダニエル電池も充電することはできません。
鉛蓄電池は充電時にどのような反応をしているのか
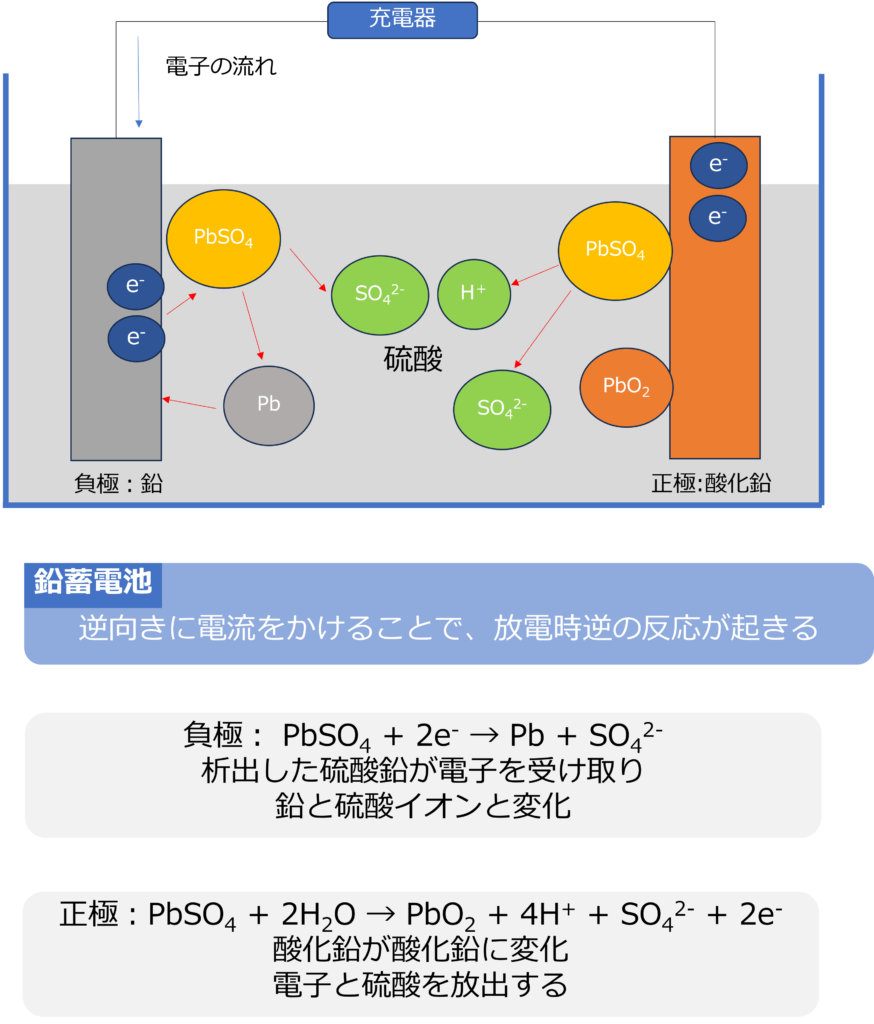
鉛蓄電池は外部から逆方向に電気を流すことで、放電時と反対の反応を起こすことが可能です。
負極では、電子が豊富な状態となるため、放電時に生成した硫酸鉛が鉛に変化します。
負極: PbSO4 + 2e– → Pb + SO42-
正極では、硫酸鉛と水が反応し、酸化鉛となります。
正極:PbSO4 + 2H2O → PbO2 + 4H+ + SO42- + 2e–
このように、逆方向の電流を流すことで、充電ができる電池を二次電池と呼びます。一方、ボルダ電池やダニエル電池、乾電池のように逆方向の反応を起こすことが難しい、不可能な電池を一次電池と呼びます。


コメント