この本や記事で分かること
・ニトロメタンの2つの窒素‐酸素結合は違うものなのか同じなのか
・共鳴とは何か
・共鳴形はどのように記述するのか
ニトロメタンの2個の窒素-酸素結合は異なるものなのか
ほとんどの化合物は、原子同士の結合を最外殻の電子を点で示したLewis構造や原子同士の結合を線で示すことができます。
しかし、一部の化合物をLewis構造などの方法を使って記載すると、矛盾が生じることがあります。
ニトロメタン(CH3NO2)をLewis構造で書くと、NO2の一つの酸素は窒素と二重結合を形成し、もう一つの酸素は窒素と単結合を形成しています。
Lewis構造では、二つの結合は異なる結合をしているようにみえますが、実験的には窒素と酸素の結合はどちらも等価な結合になっています。
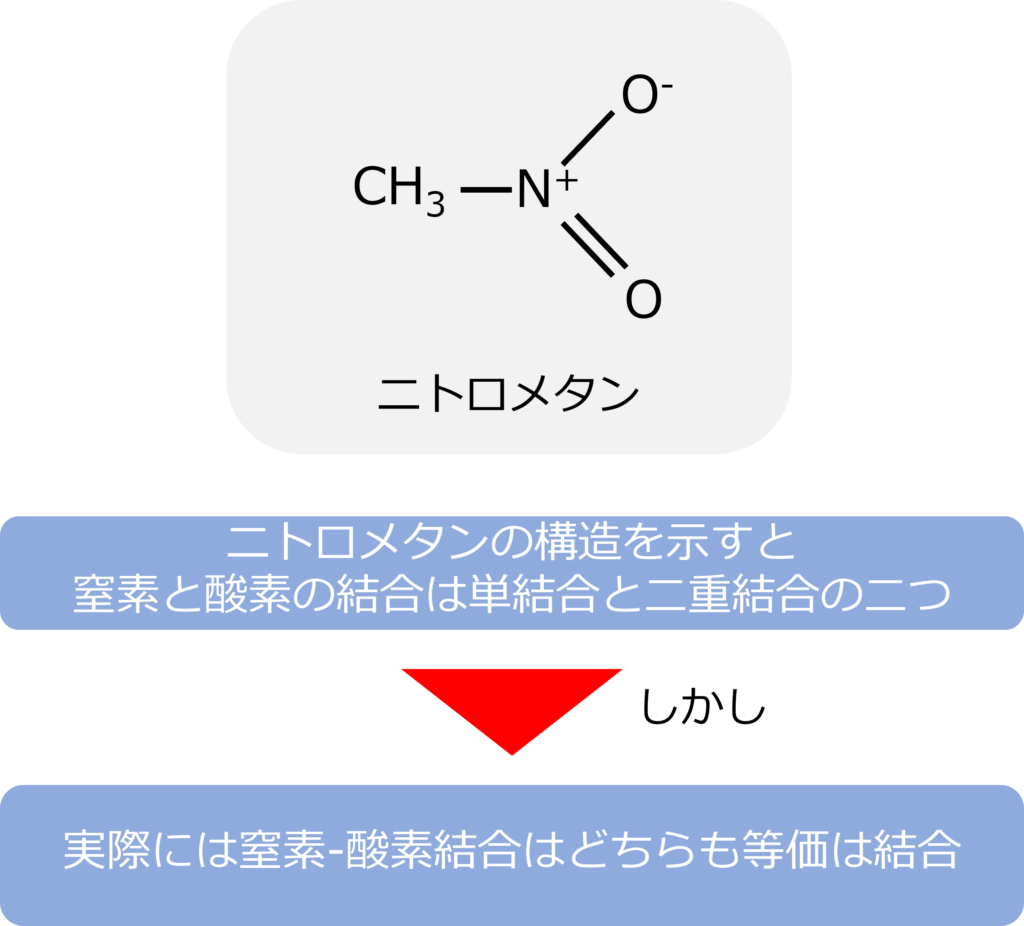
ニトロメタンの構造はどのように記載されるのか
一般的なN-Oの単結合の距離は130pmであり、N=Oの二重結合の距離は116pmとなっています。
ニトロメタンの窒素と酸素の結合は両方とも同じで、その距離は122pmと単結合と二重結合の中間の値になっています。
ニトロメタンの窒素と酸素の結合は片方が単結合、片方が2重結合という形ではなく、両者の中間の結合を持っています。
ニトロメタンは二つのLewis構造で示すことが可能であり、2つのLewis構造は共鳴形とよばれ、両者を矢印同士でつなぐ形で表されます。
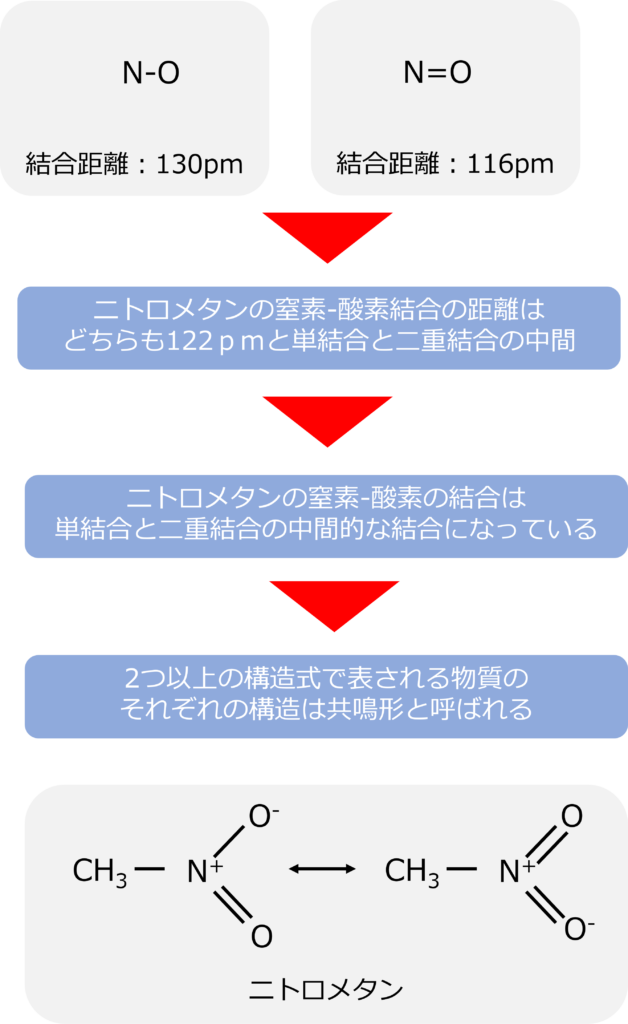
共鳴とは何か
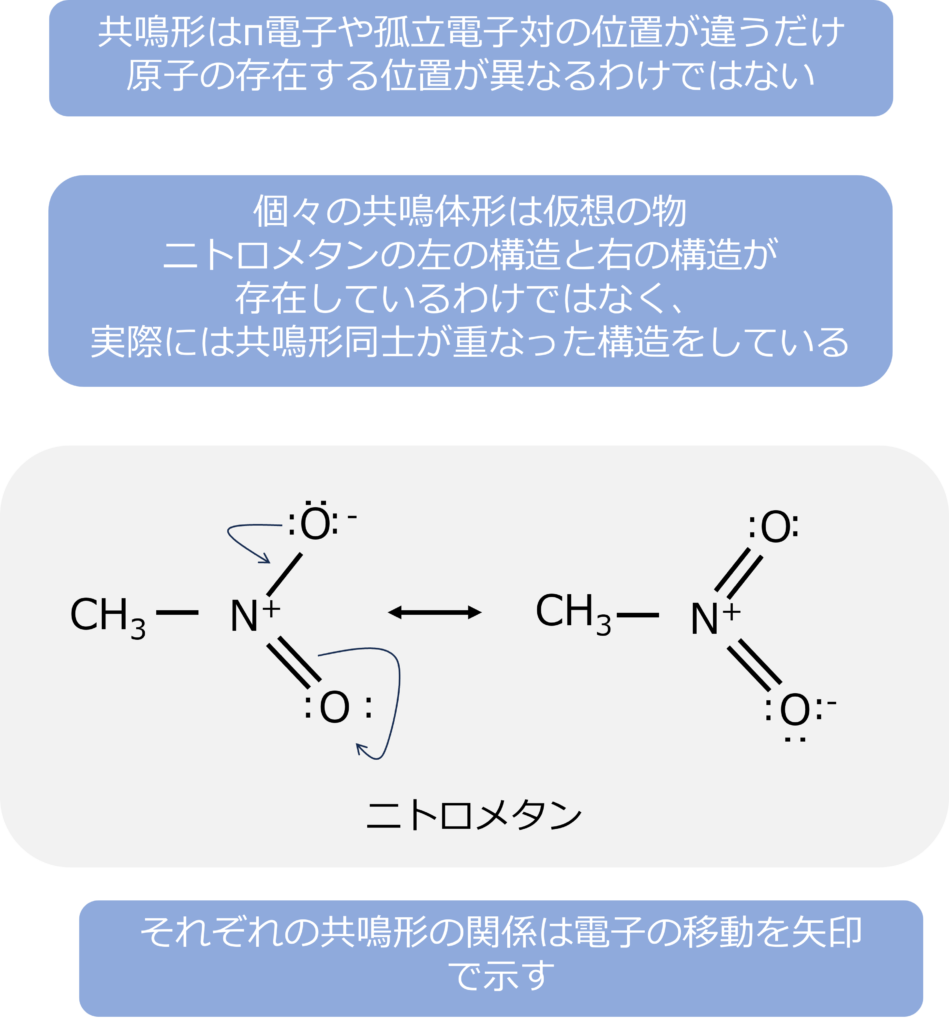
共鳴形はπ電子や孤立電子対の位置が違うだけでの関係にあり、共鳴体同士で原子の存在する位置が異なることはありません。
また、個々の共鳴形は仮想の物であり、各共鳴体のものが存在しているわけではなく、両者の構造を重ね合わせた中間の構造になっており、このような中間構造を共鳴混成体と呼びます。一般に共鳴は安定化をもとらすため、共鳴形の数が多いほど、その物質は安定となります。
共鳴形同士の関係は電子の移動を矢印で示されます。
ニトロメタンの場合、窒素と単結合しているO-の孤立電子電子がN-O結合に移動し、窒素との2重結合を形成します。同時に窒素と酸素の二重結合の電子がもう一つの酸素のほうに動いていて、孤立電子対を形成することでそれぞれの共鳴形の関係を表すことができます。
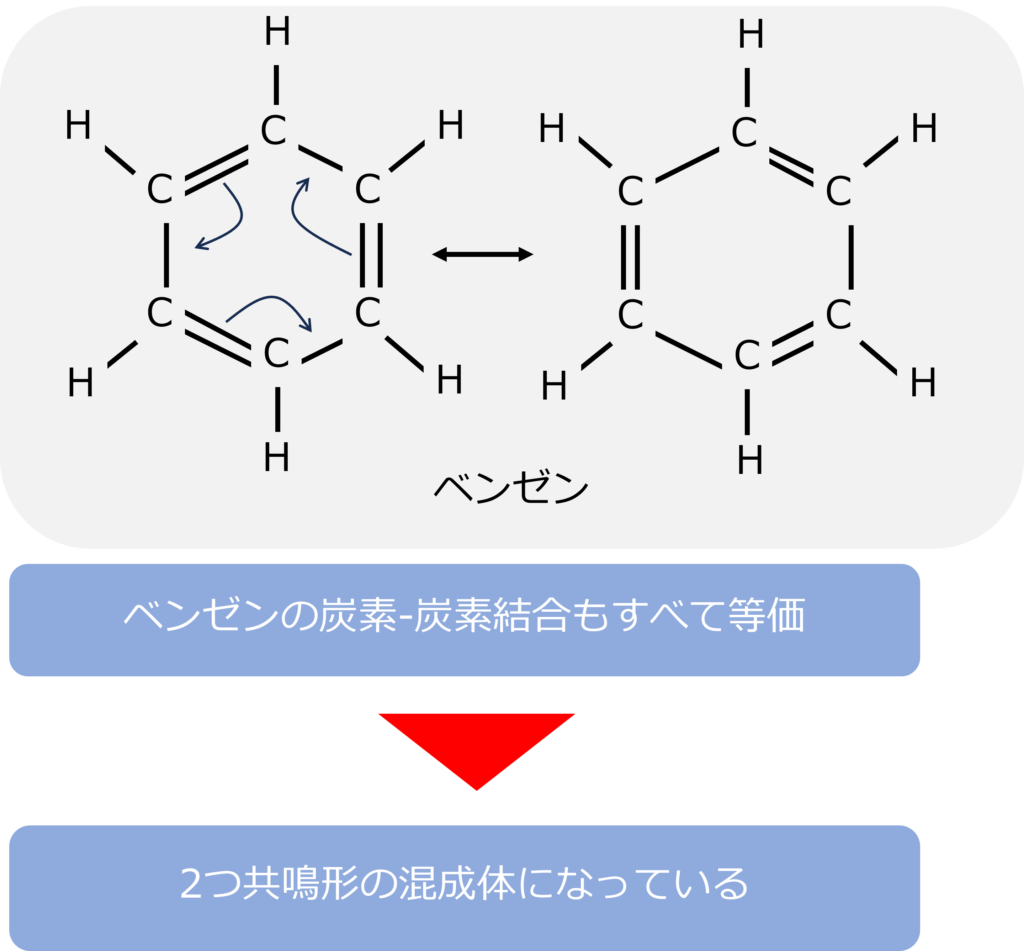
ベンゼンはどのような共鳴体を持つのか
ベンゼン(C6H6)を含む化合物は芳香族化合物と呼ばれ、炭素同士が二重結合と単結合で形成されているように見えます。
しかし、ベンゼンの炭素-炭素もすべて等価であることが分かっており、二つの共鳴形の混成体であることがわかります。
ベンゼンの共鳴体同士の関係は、二重結合の電子が隣の単結合に移動することで表すことができます。
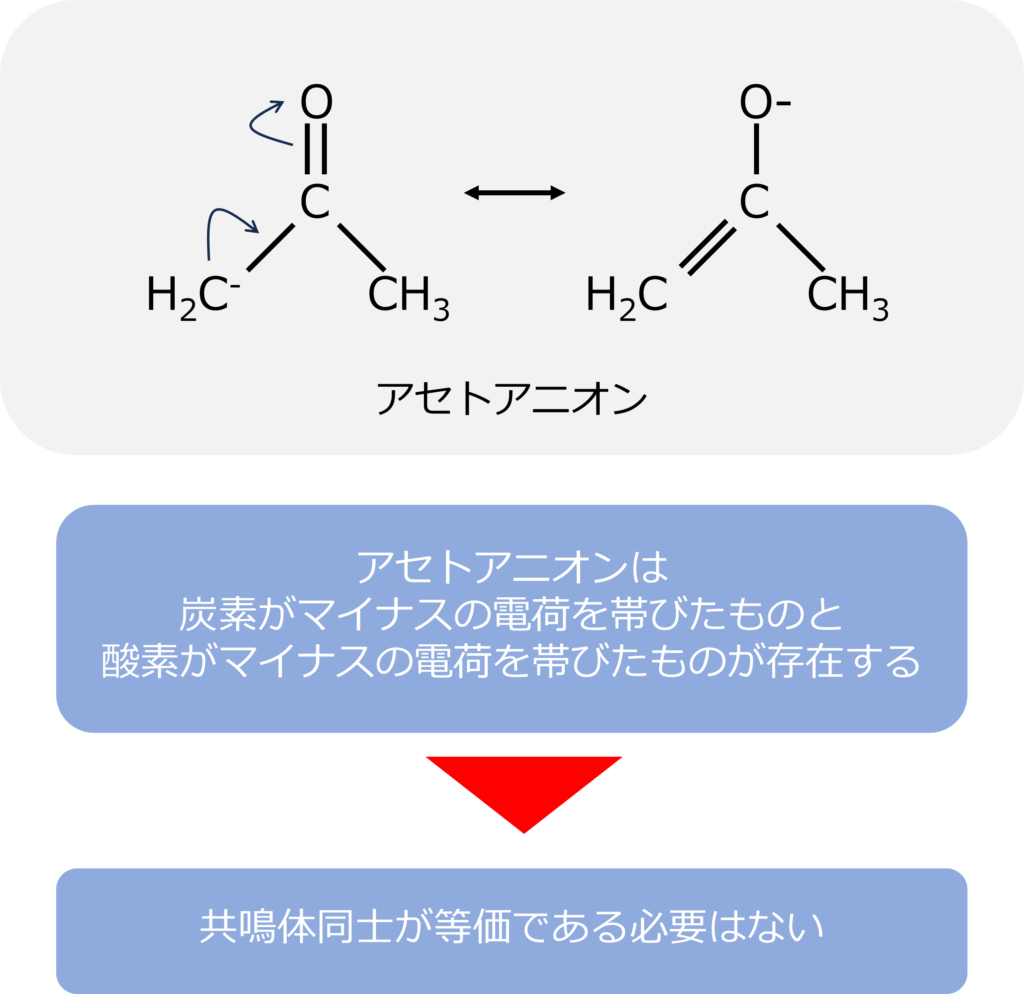
アセトアニオンの共鳴体同士はどんな関係にあるのか
アセトン(C3H6O)はケトンと呼ばれる物質で有機溶媒として広く利用されています。アセトンは強い塩基の存在下では炭素と結合した水素が引きぬかれ、アセトアニオンという化合物になります。
水素を引き抜かれた側の炭素はマイナスの電荷を持つことになります。炭素上の電子は炭素と炭素の単結合に移動し、二重結合を形成し、中央の炭素と酸素の二重結合の電子が酸素の移動し、酸素上にマイナスの電荷を持つ構造となります。
アセトアニオンのように個々の共鳴形同士は等価である必要はありません。


コメント