この本や記事で分かること
・物質の状態にはどんなものがあるのか
・物質の状態はどのように変化するのか
物質にはどんな状態があるのか
身の回りの物質は、固体、液体、気体の3つの状態に分けられます。その特性には様々な差異があり、その一つが何かの容器に入れたときの様子です。
固体は容器から出しても形や体積の変化がありません。
液体は体積は変わらないものの、容器の形状に合わせて、形が変化します。
気体は、容器に入れても、周囲に広がっていってしまいます。
また、一部の色のある気体を除いて、気体を目にすることはできません。

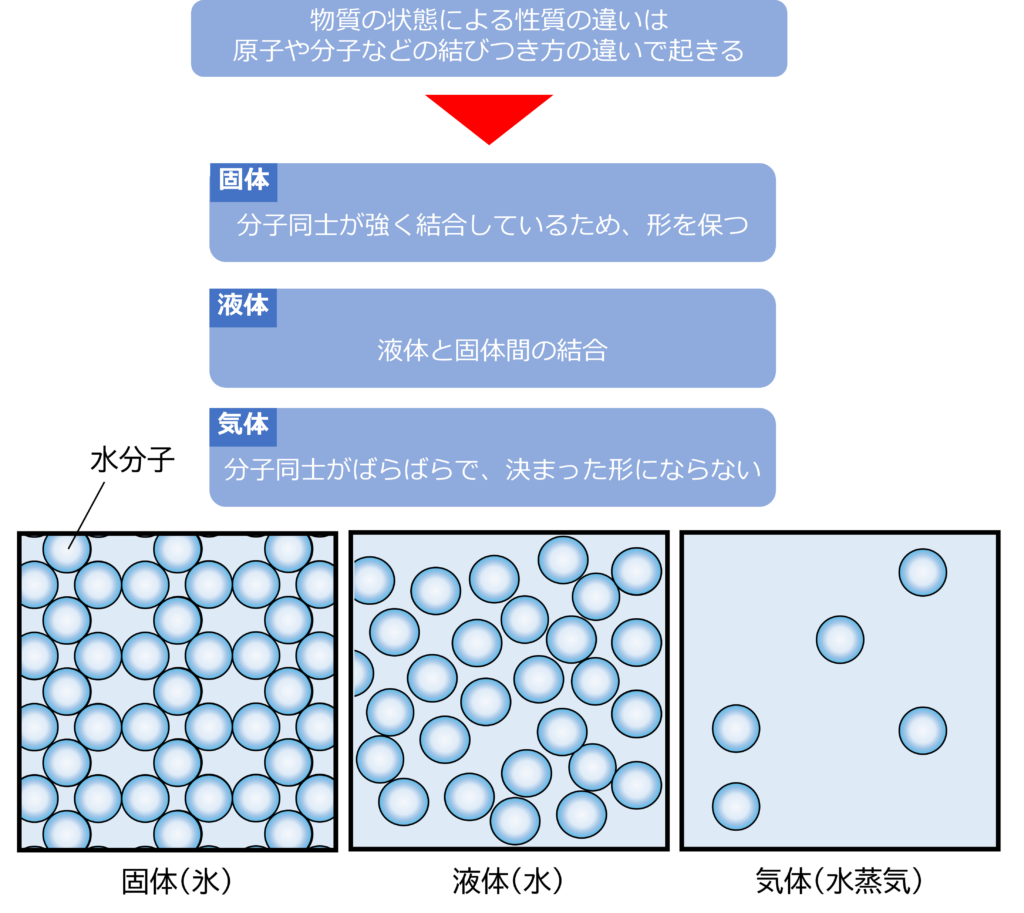
3つの状態にはどんな違いがあるのか
3つの状態の違いは原子、分子、イオンの集まり方、結びつきの強さによってもたらされています。
固体は分子同士が互いに引き合い、強く結合しています。そのため、容器から出しても形が変わることなく、一定の形を保つことができます。
気体は分子同士の結びつきがなく、一個一個の分子ばがばらばらで存在しており、その分子は凄まじいスピードで飛び回っています。分子同士は衝突しながらも、ばらばらの状態であるため、決まった形をとることなく存在しています。
また、一個一個の分子はとても小さいため、気体を目で見ることはできません。
液体は固体と比較すると結合が弱く、気体と比べると強い結合をもっています。そのため形を変えることはできますが、ある程度の結合力があるため、ばらばらになることはありません。
物質状態はどうやれば変化するのか
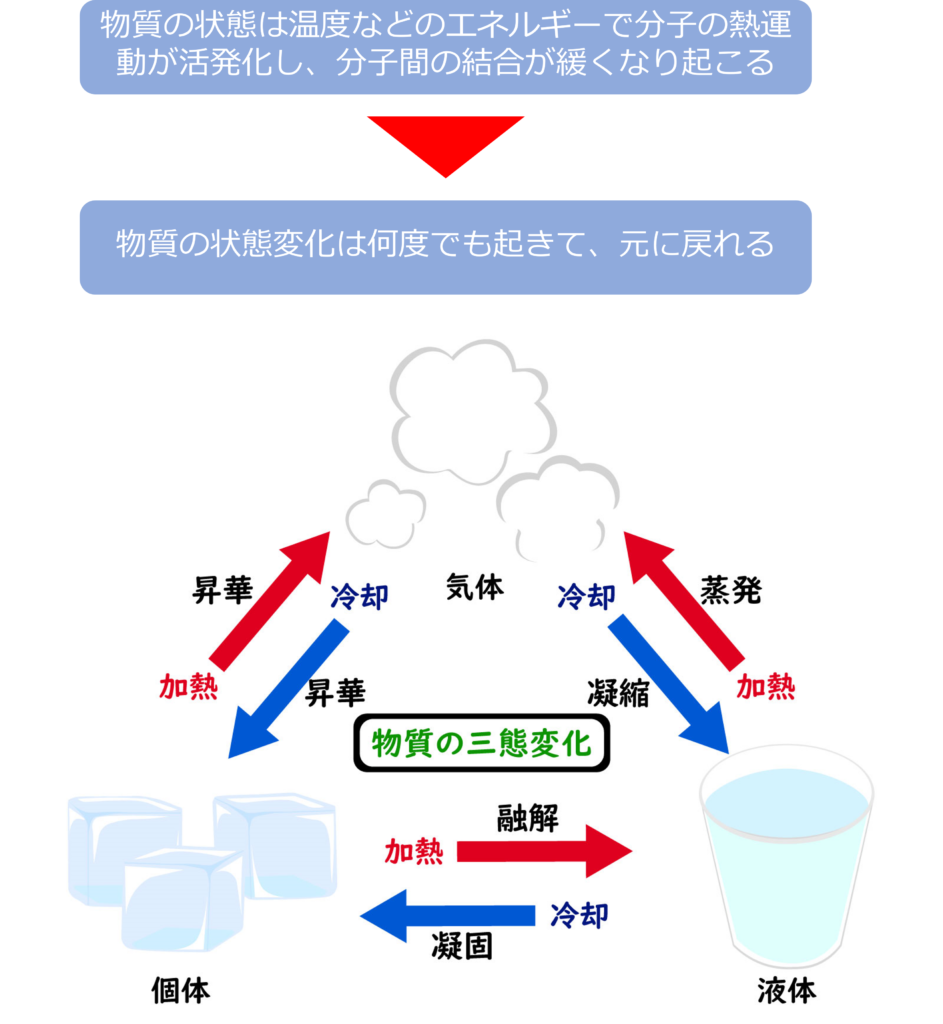
物質の状態は主に温度によって変化します。また、状態の変化は別の物質に変わるわけではないので、何度でも、もとの状態に戻ることが可能です。それぞれの状態変化は以下のような名称で呼ばれます。
固体→液体:融解、液体→個体:凝固
固体→気体:昇華、気体→固体:凝華
液体→気体:蒸発、気体→液体:凝縮
分子などの粒子は熱を加えられることで、エネルギーを得ると、熱運動が活発化していきます。熱運動によって分子間の結合が緩くなることで、固体は液体に、液体は気体へと状態変化していきます。
沸騰とはどんな状態なのか
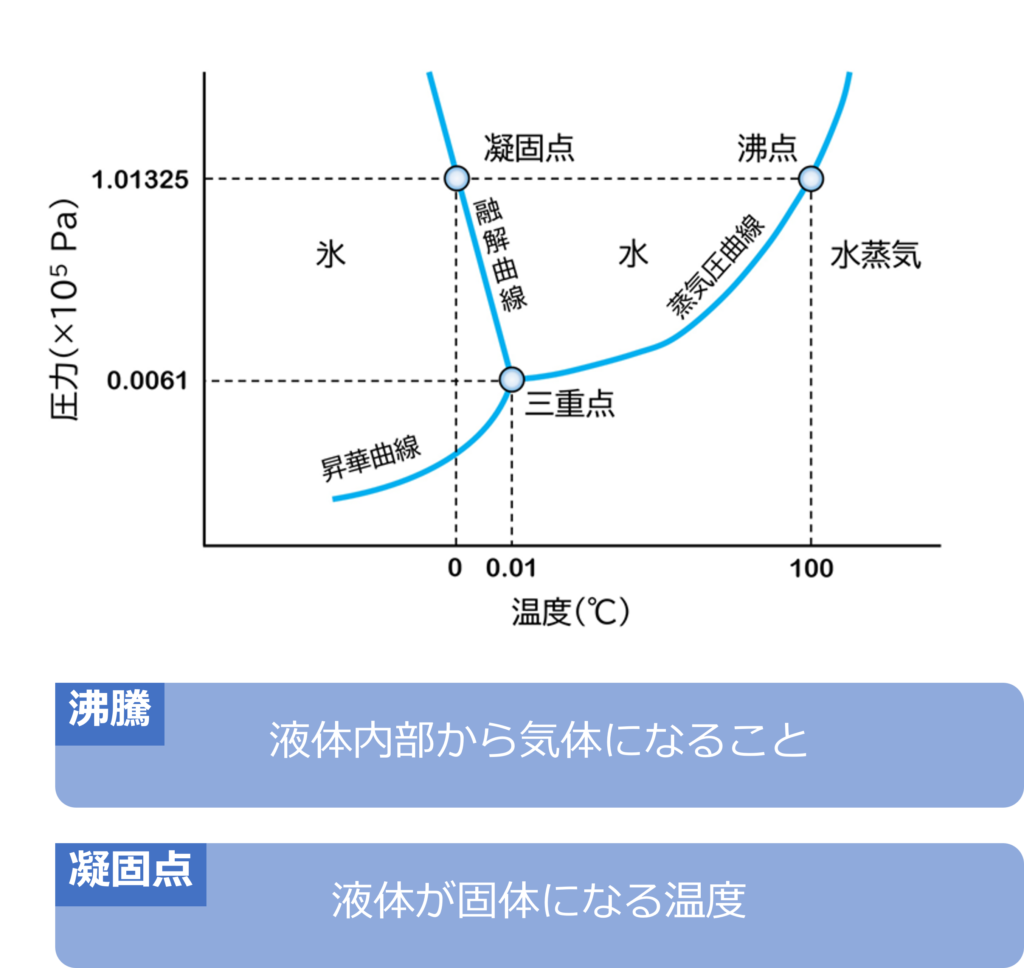
熱運動が活発なほど、分子同士の距離が遠くなるため、多くの物質が同じ重さでは固体、液体、気体の順に体積が大きくなります。(水は例外的に液体よりも固体のほうが体積が大きくなります。)
大気圧下で液体が内部から気体になることを沸騰といい、沸騰が起こる温度を沸点と呼びます。
固体が融解し、液体となる温度は融点、液体が個体へする温度を凝固点と呼び、融点と凝固点は同じ温度になります。
冷蔵庫から氷を放置しておくと、溶けて(融解)水になります。
氷が解けている間は熱エネルギーはすべて氷の溶解に使用されるため、融点である0℃からあがることはありません。
凝固点降下となにか
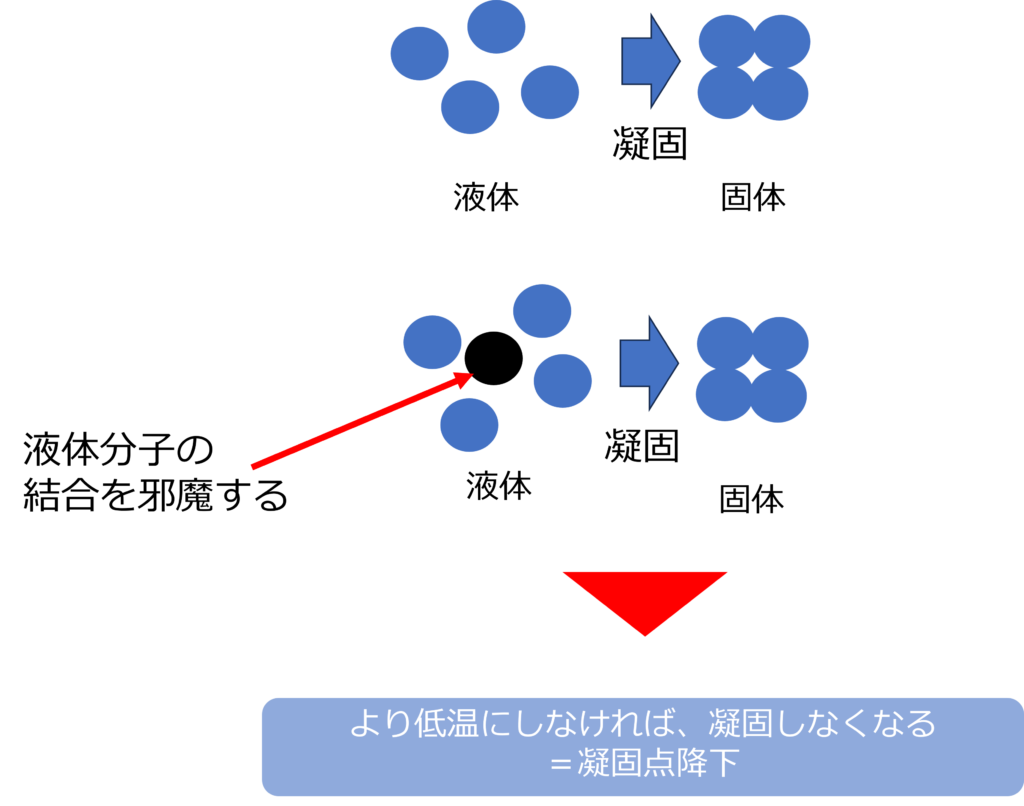
沸点や融点は純物質であれば、物質の種類によって一定になりますが、不揮発性の物質が溶解している液体は沸点が上がったり、凝固点が下がります。
溶質が溶けたことで、溶媒の割合が減少し、気体になる割合も減少するため、より高温にしなければ沸騰することはありません。
溶質分子が凝固する液体分子が整列する動きを妨げるため、より低温にしなければ、凝固しなくなります。
沸点上昇も、凝固降下も解けている物質の分子の種類は関係なく、溶解している分子数に比例します。ただし、溶解時にイオンとなる物質はイオンの数に比例します。
そのため、溶解した際に多くイオン化する物質のほうが、より大きな凝固点降下を得ることが可能です。
雪が降った際に、塩化ナトリウムや塩化カルシウムを道に撒いておくのは、水の凝固点を降下させ、路面の凍結を防ぐためのものです。
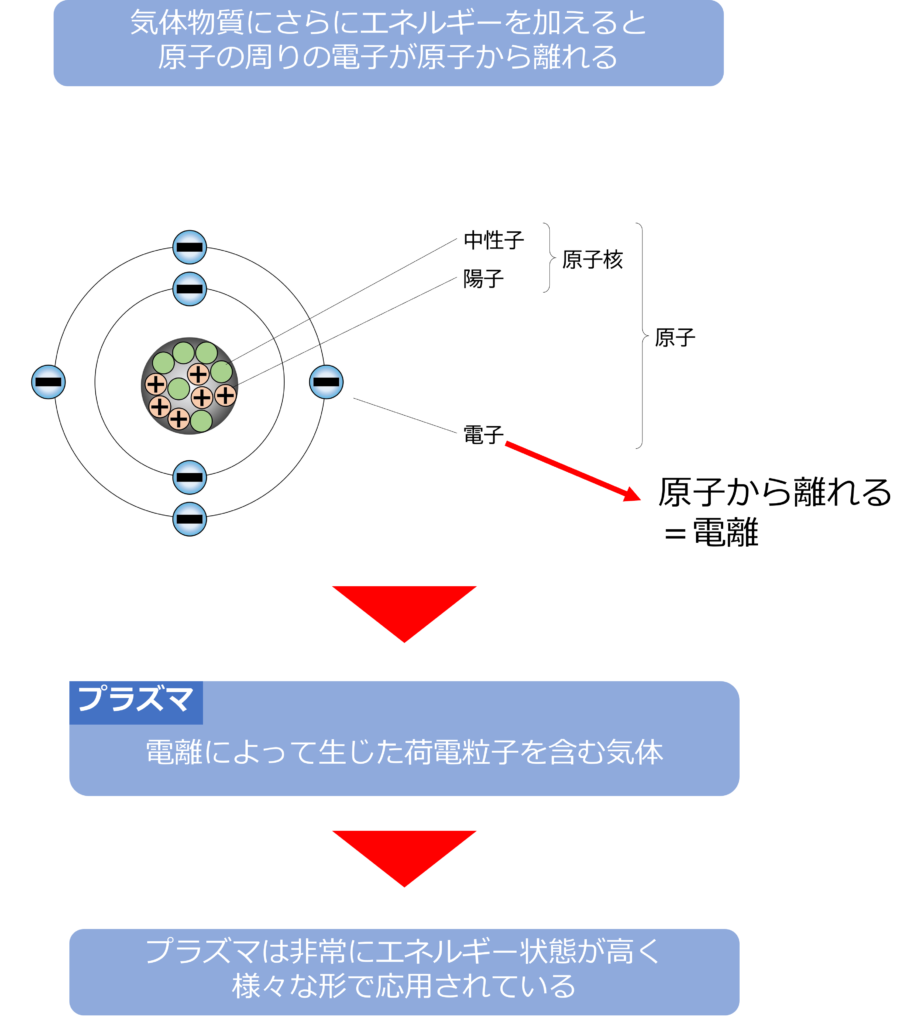
プラズマとはどんな状態か
気体になった物質にさらにエネルギーを加え続けると、物質の第4の状態と呼ばれるプラズマという状態になります。
気体は分子間同士が離れた状態で飛び回っていましたが、プラズマは分子が陽イオンと電子に分けられた状態にあります。
プラズマとなった物質はとても不安定で、高いエネルギー状態となるため、とても反応性に富んでいるため、様々な産業で応用されています。


コメント