この本や記事で分かること
・原子はどんな構造をしているのか
・電子の重要性と電子がどのように存在しているのか
・電子の数と物質の安定性の関係
原子はどのような構造をしているのか
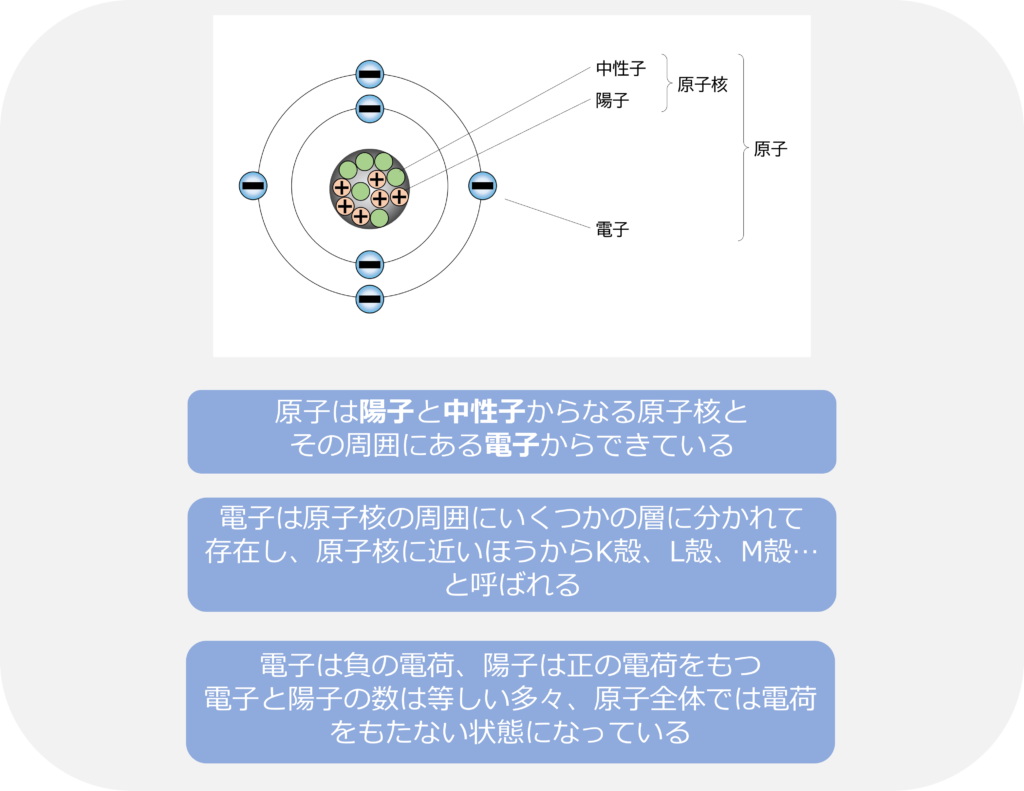
20世紀に入ると、原子はさらに小さい粒子から構成されていることが、明らかになっていきます。原子は陽子と中性子からなる原子核とその周囲にある電子からできています。
電子は原子核の周囲にいくつかの層に分かれて存在しています。
電子の存在する層は電子殻と呼ばれ、原子核に近い側から、K殻、L殻、M殻…と呼ばれています。
最も外側の電子殻に入っている1~7個の電子は価電子と呼ばれ、原子同士の結合や化学反応に重要な働きをしています。
陽子、中性子と電子の違いは何か
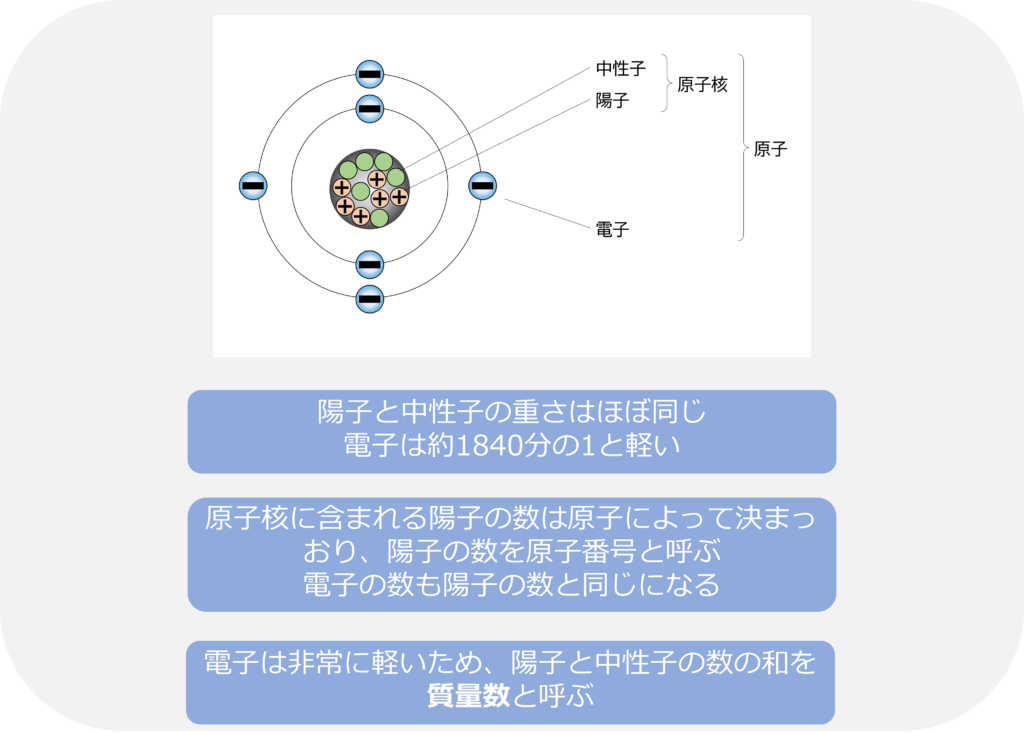
原子の質量のほとんどは原子核で占められており、正の電荷をもつ陽子と電荷をもたない中性子からできています。
陽子と中性子はほぼ同じ質量であり、電子は中性子や陽子と比べてとても軽い(陽子の約1840分の1)という特徴があります。
電子は負の電荷をもっており、陽子の持つ電荷と等しい数であるため、原子全体では電荷をもたない状態となります。
原子核に含まれている陽子の数は元素によって決まっており、その数は原子番号と呼ばれます。電子の数と陽子の数は同じになるため原子番号と電子の数は等しくなります。
電子は中性子や陽子のと比較して無視できるほど軽いため、陽子の数と中性子の数の和を原子の質量数と呼びます。
電子はどのように存在しているのか
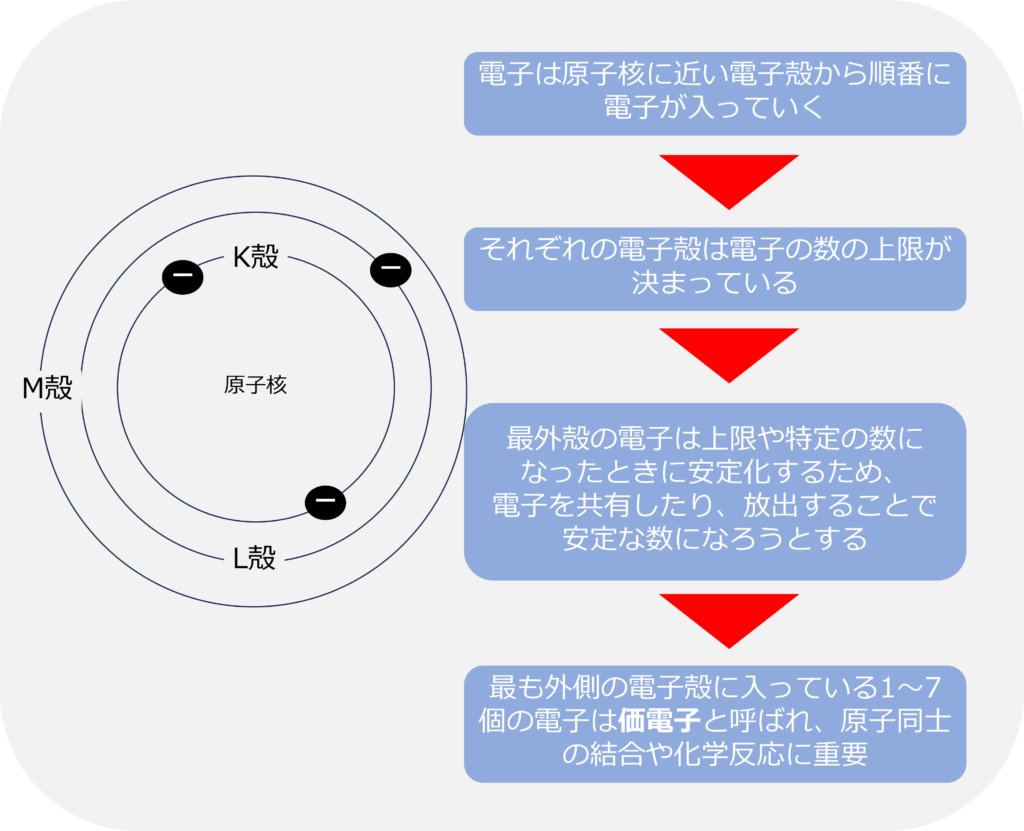
電子の存在する電子殻は、原子核に近い側から、K殻、L殻、M殻…となっており、電子は原子核に近い原子殻から順番に電子が入っています。
また、電子殻に入ることのできる電子の数は上限が決まっており、K殻には2個、L殻には8個、M殻には18個の電子が入ることができます。
電子の入っている最も外側の電子殻を最外殻と呼び、最外殻に入っている電子である価電子は、他の原子との結合や反応に重要な役割を果たしています。
最外殻の電子はそれぞれの電子の上限や特定の数になったときに安定化するため、多くの原子は電子を共有したり、放出することで、安定化する電子数の数になろうとしています。
原子はどのような電子配置になろうとするのか
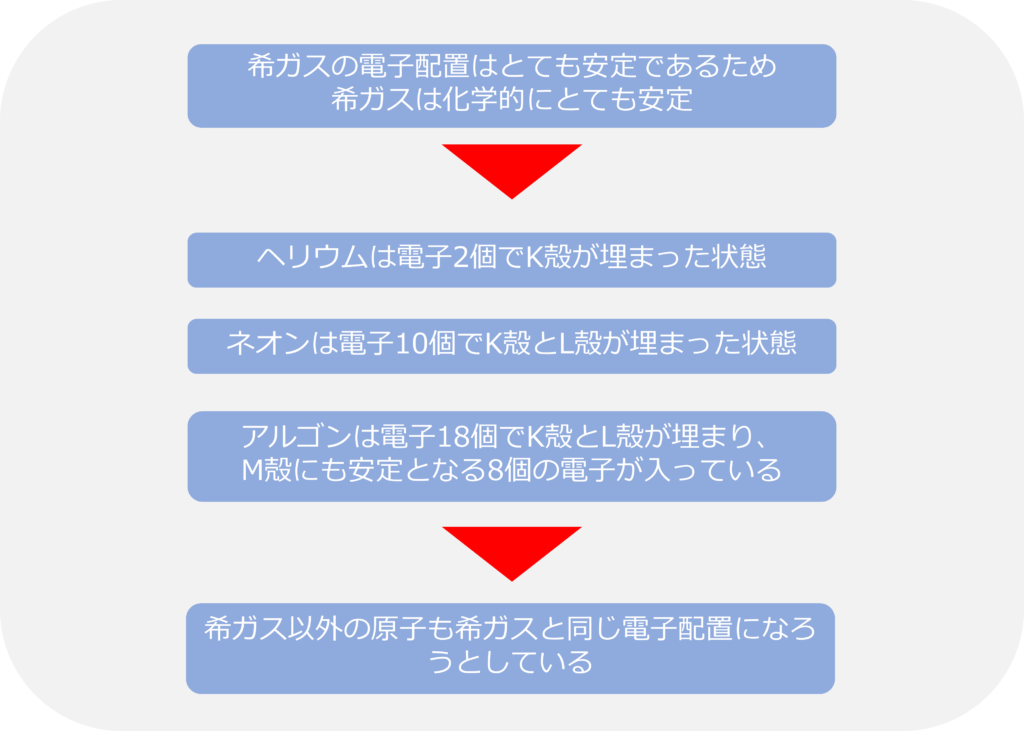
周期表の一番、右に配置されている希ガスは最外殻の電子が安定的な数となっているため、化学的にとても安定であり、他の物質と反応することも少なくなっています。
Heは電子2個でK殻が埋まった状態です。Neは電子を10個持ち、K殻に2個、L殻に8個でこちらもそれぞれの電子殻が埋まった状態になっています。
Arは18個の電子を持っており、K殻に2個、L殻に8個の電子が入った後に、M殻に8個の電子が入っていきます。M殻は18個の電子が入ることができますが、8個電子が入ることで安定化するため、Arも他の希ガスと同様安定的な性質を持っています。
物質にはなるべく安定な状態になろうとする特徴があるため、希ガス以外の原子も希ガスと同じ電子配置を取ろうとする傾向を持っています。
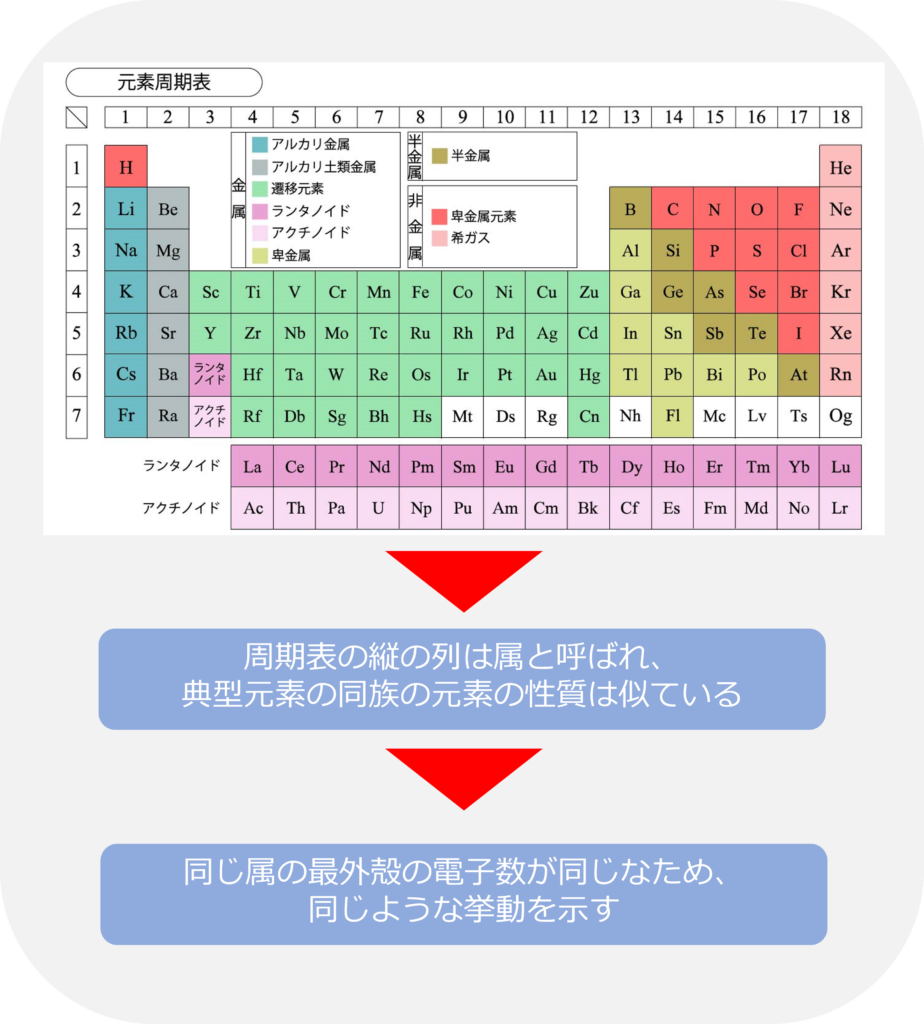
なぜ、同じ属の原子の性質が似ているのか
周期表の縦の列は族と呼ばれ、典型元素では同じ属同士の原子同士の性質は似通っています。
これは、同じ属の最外殻の電子数が同じであるためです。最外殻の電子数の少ない1族や2族の原子は電子を放出することで安定化を図ろうとし、17族の電子はあと1個で最外殻の電子数が安定になるため、電子を取り込むことで安定化をしようとします。
原子の反応性はどう決まるのか
1族や2族の原子は、どれも電子を放出しやすい傾向ですが、周期表の下にある原子ほど、電子数が多いため、最外殻と原子核の距離が遠くなります。
最外殻と原子核の距離が遠くなると原子核の影響が小さくなり、電子が原子から離れやすくなります。そのため周期表の下の原子ほど電子を失う反応を激しく起こすようになります。
16、17族の原子は最外殻の電子と距離が近いほうが原子核の与える影響が大きいため、周期表の上の元素ほど電子を受け入れやすくなります。

金属の反応性はどう決まるのか
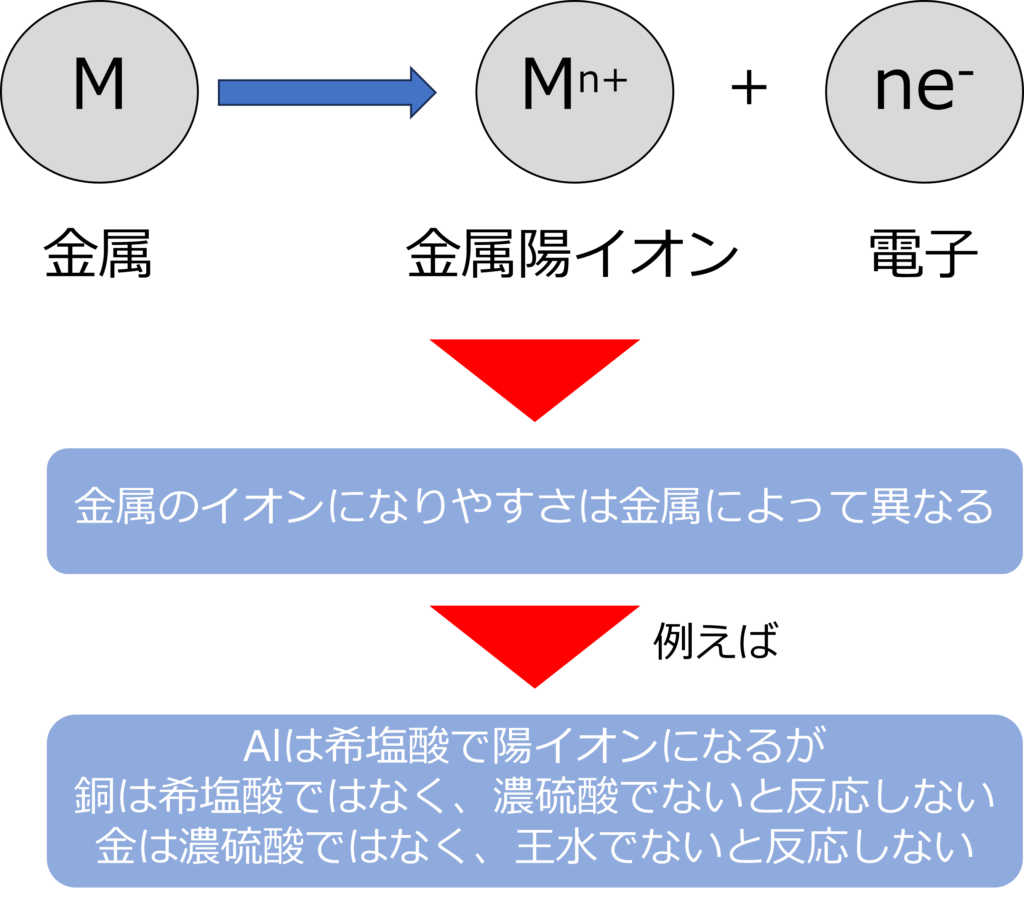
金属の反応性の違いも電子が関係しています。
金属は電子を放出し、陽イオンになろうとする性質がありますが、イオンになりやすさには金属によって異なっています。
アルミニウムや亜鉛は希塩酸に入れると容易に溶解しますが、銅は希塩酸では溶解せず濃硫酸などの酸化力のある酸でなければ溶解しません。
金はさらにイオン化しにくく反応性が低いため、濃硫酸にも溶けず、王水(濃硝酸と濃塩酸の混合物)にしか溶けません。
イオン化傾向とは何か
金属が陽イオンになろうする性質をイオン化傾向と呼び、イオン化傾向の大きいものから順番に並べたものをイオン化列と呼びます。
イオン化傾向が高いものほど、電子を放出しやすく、陽イオンになりやすいため反応性が高くなります。
人類は古代から銅や金を利用し、その後、鉄など徐々にイオン化傾向の大きい金属を利用するようになりました。アルミニウムを金属として使用できるようになったのは19世紀後半とかなり遅くなっています。
イオン化傾向の高い金属は反応性が高いため、単体で存在しておらず、化合物をつくる際の結びつきも強くなります。
そのため単体の金属として利用することは難しく、まずは単体で存在しやすく、化合物との結びつきも弱いイオン化傾向の小さい金属を利用してきました。



コメント