この本や記事で分かること
・分子がどんな立体構造を持っているか
・電子が分子の立体構造に影響を与える理由
・水分子とメタン分子の立体構造の違いが起こる原因
水素分子はどのような構造をしているのか
共有結合によって、原子同士が結合していますが、実際にどのような形をしているのかは、それぞれの分子によって様々です。
どのような構造になっているのかにも電子は関わっています。
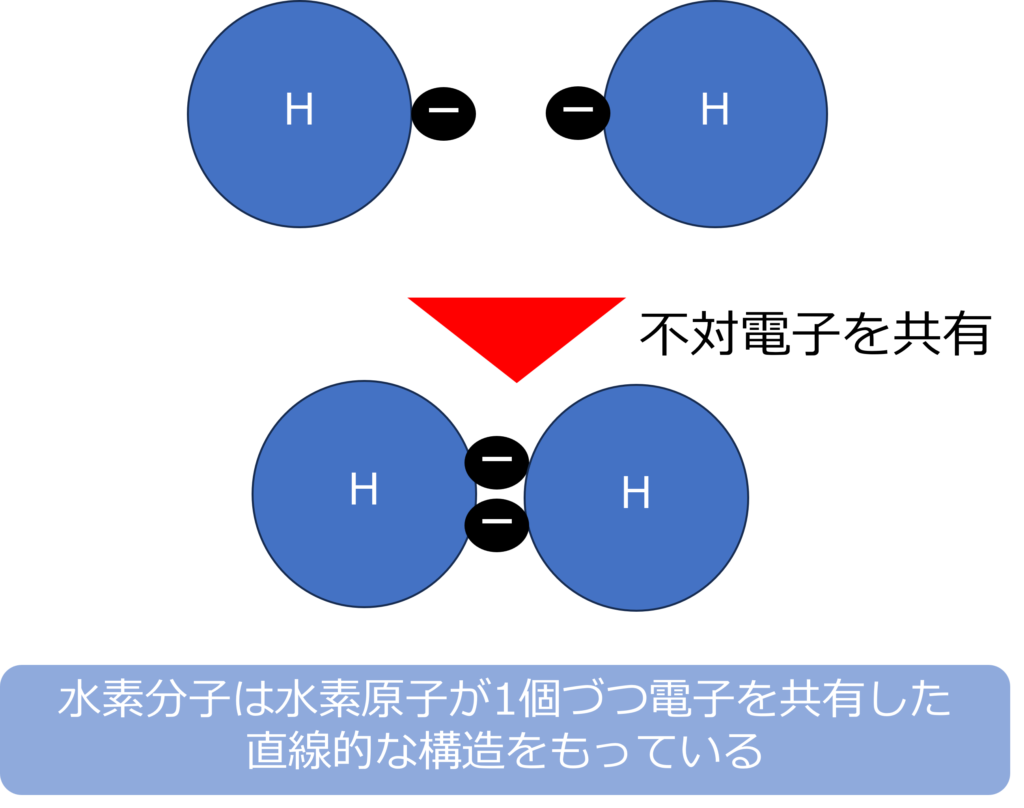
水素分子は水素原子が1つづつ電子を共有することで、結合を形成しています。そのため、水素分子は直線的な構造を持つ分子になっています。
水分子も直線的な構造なのか
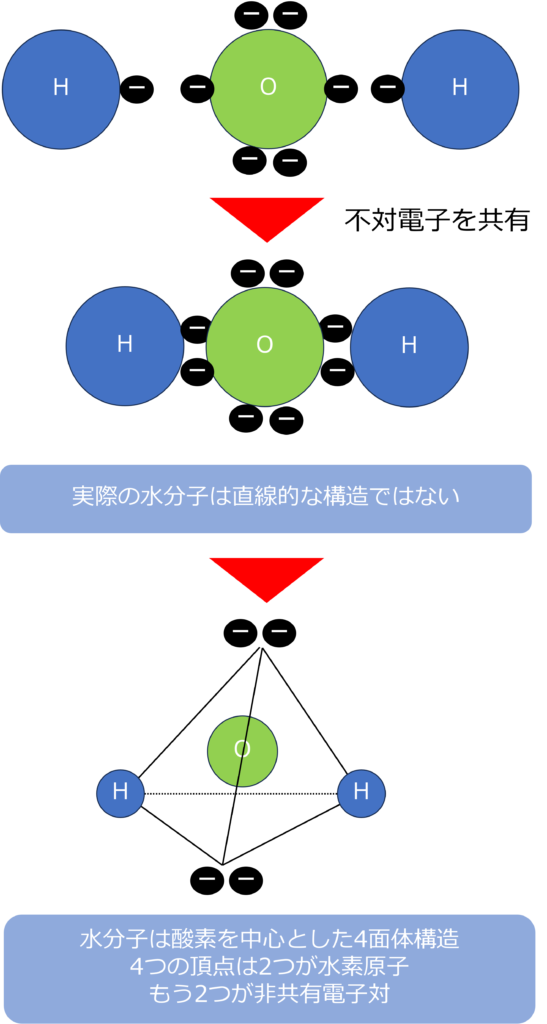
水分子(H2O)も分子式だけを見ると、酸素の両脇に水素が結合した、直線的な分子と思ってしまいます。
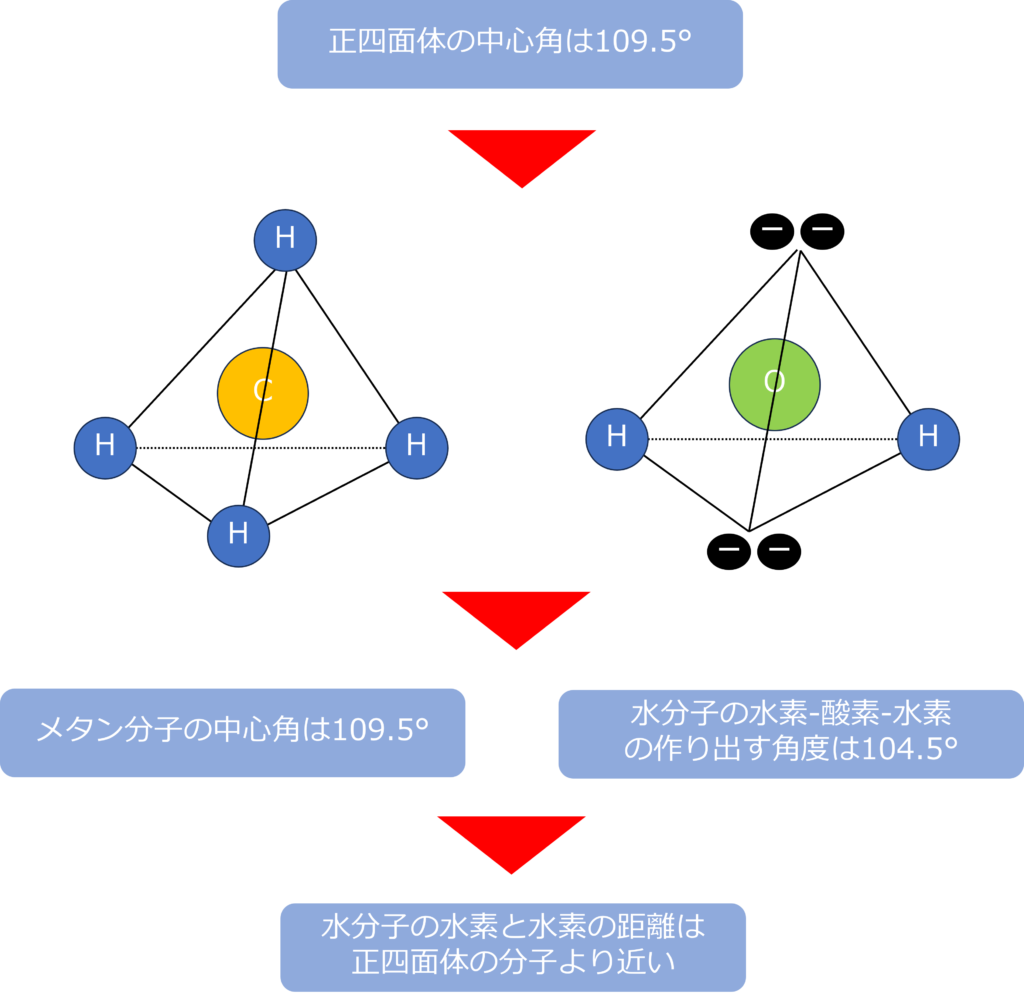
しかし、実際の水分子は四面体構造を持っています。
酸素原子はsp3混成軌道を形成することで、二つの水素原子と結合を形成しています。そのため最外殻には二つの非共有電子対が存在しています。
二つの非共有電子対も酸素原子から飛び出して、存在しているため水分子は直線的な構造を取らずに、酸素から4つの軌道が伸びた形となります。
そのため、水分子は酸素を中心として、二つの水素原子と二つの非共有電子を頂点とした四面体構造を持っています。
メタン分子はどんな構造なのか
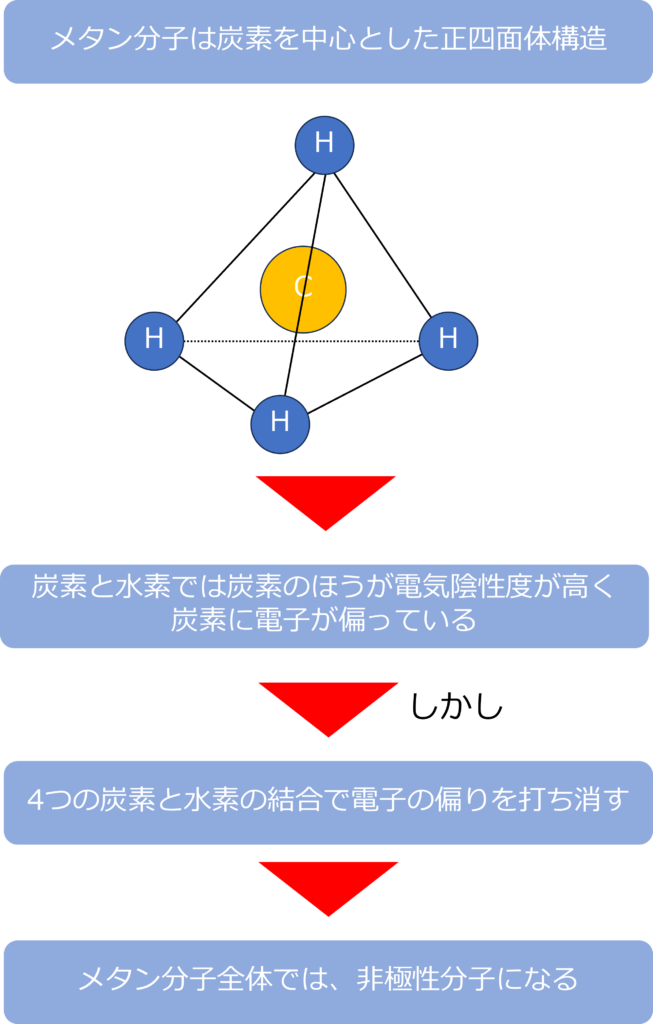
メタン(CH4)はsp3混成軌道を形成し、4つの炭素-水素結合を形成しています。
炭素と水素では電気陰性度(電子を引き付ける力)が炭素のほうが強いため、炭素のほうに電子が偏っています。
しかし、極性を持つ結合がからなるにも、関わらず、実際のメタンは無極性分子となっています。
これは、メタン分子が炭素を中心とした正四面体構造であり、それぞれの炭素-水素結合が完全に等価であり、それぞれの結合の極性が打ち消しあっているためです。
なぜ、水分子は極性を持つのか
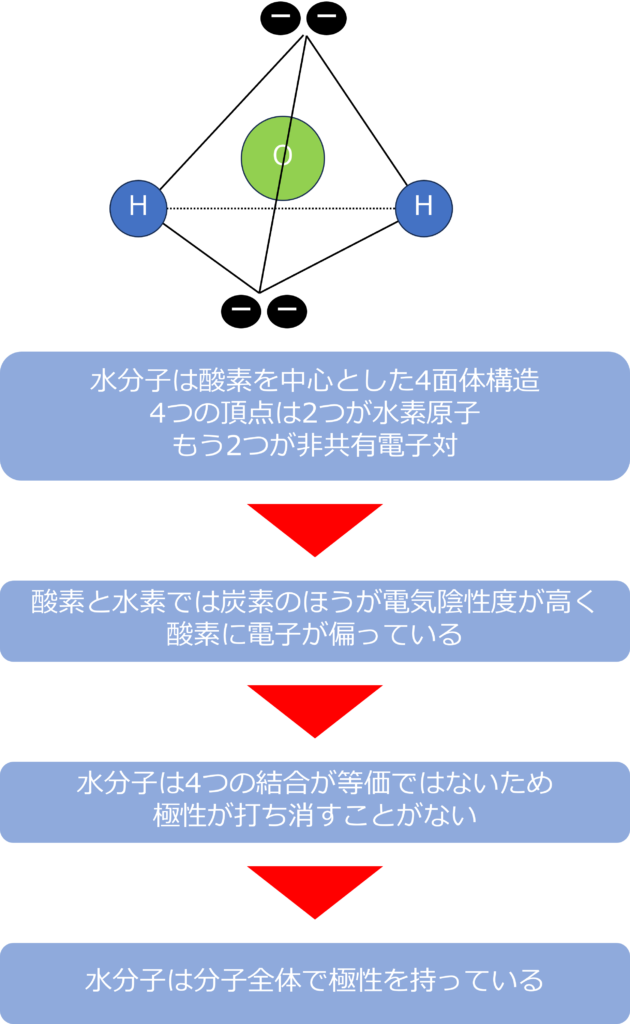
水分子もメタンと同じく、4面体構造を持っていますが、極性分子になっています。
酸素のほうが水素よりも電気陰性度が高く、酸素-水素間で極性が発生しています。
メタンの場合は、4つの炭素‐水素の結合からなる正四面体構造だったため、結合間の極性が打ち消し合うことで無極性分子となっていましたが、水の場合は4面体の頂点の二つが水素、残り二つが非共有電子対であるため、極性が打ち消しあうことがないため、分子全体で極性を持っています。
水分子は極性をもっていることで、水素結合を形成することができています。
水分子もメタンと同じ正四面体構造なのか
正四面体構造の分子では、四つの頂点はできる限り離れて、安定的な構造になろうとします。
正四面体の中心と隣り合う二つの頂点が作り出す角度(中心角)は109.5°となっており、メタンは四つの等価な炭素‐水素の結合からできた正四面体構造であるため、中心角の角度は109.5°となっています。
一方で、水分子の水素‐酸素‐水素の作り出す中心角は104.5°、同じく四面体構造を持つアンモニアの窒素‐水素結合は106.7°になっています。
水やアンモニアは、正四面体構造の分子と比較し、水素同士の距離が近い構造をしています。
なぜ、水分子は正四面体構造ではないのか
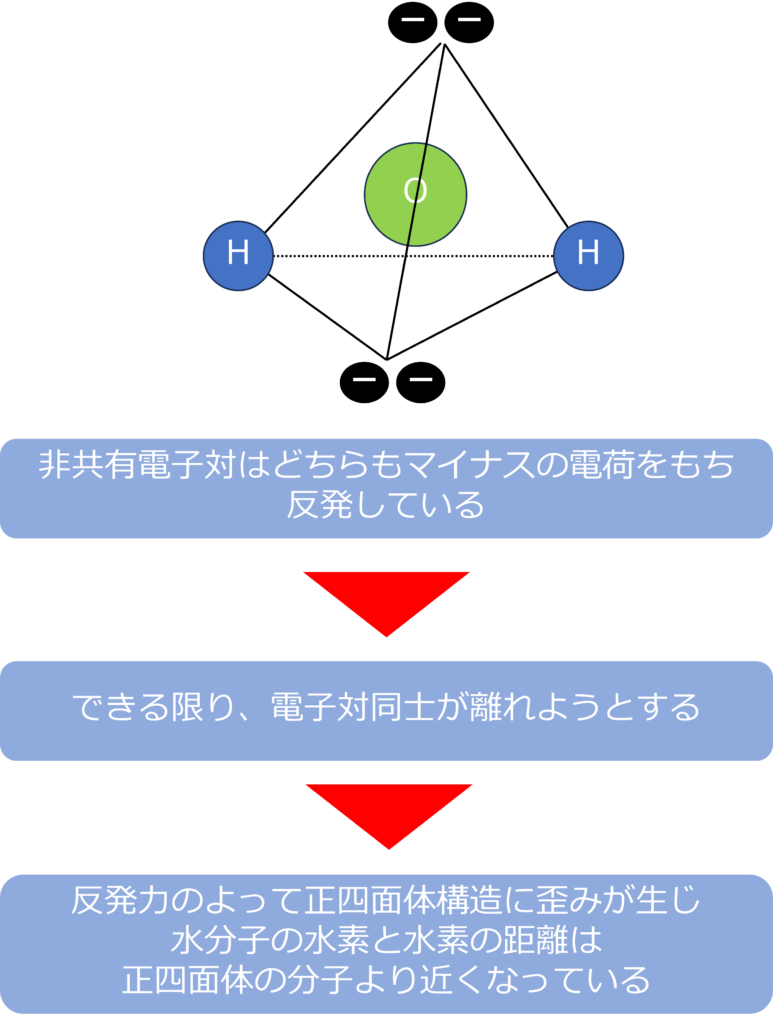
水分子は四面体構造をしているものの、頂点のうち二つは非共有電子対になっています。
非共有電子対はどちらもマイナスの電荷をもっているため、反発しています。
そのため結合が切れない範囲で、できる限り電子対同士が離れようとしています。
水分子の二つの非共有電子対にも反発力が働いており、その反発力によって、正四面体構造にゆがみが生じています。
そのため、水分子の水素同士の距離は正四面体構造の頂点同士と比較すると、近くなっています。


コメント