この本や記事で分かること
・電子の偏りが生じる理由
・電子の偏りによって化学反応をどのように進行するのか
・求核試薬、求電子試薬とは何か
結合の電子の偏りはなぜ起きるのか
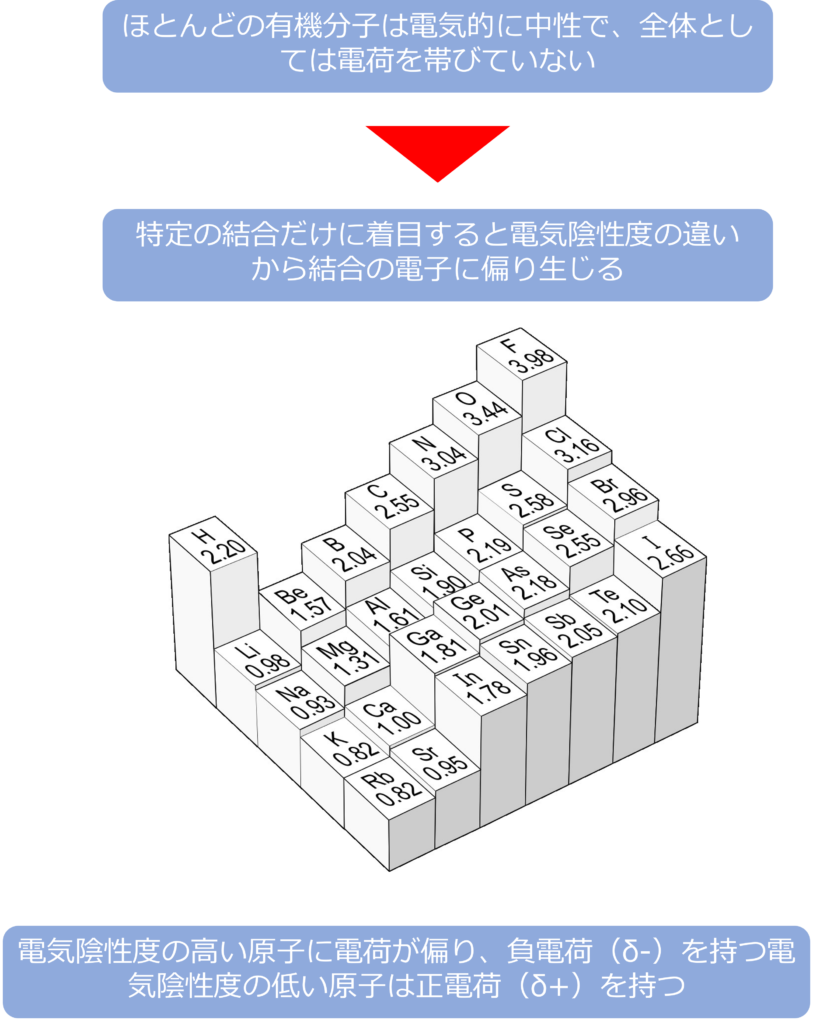
ほとんどの有機分子は電気的に中性で、全体としては電荷を帯びていません。しかし、特定の結合だけに着目すると電気陰性度の違いから結合の電子に偏りがみられます。
電気陰性度の高い酸素や、窒素、塩素などが炭素と結合している場合、電気陰性度の高い原子に電荷がかたより負電荷(δ-)を持ち、炭素は正電荷(δ+)を持っています。
逆に電気陰性度の低いリチウムなどと炭素が結合すると電気陰性度の低い原子が正電荷(δ+)を持ち、炭素が負電荷(δ‐)を持っています。
分極率とは何か
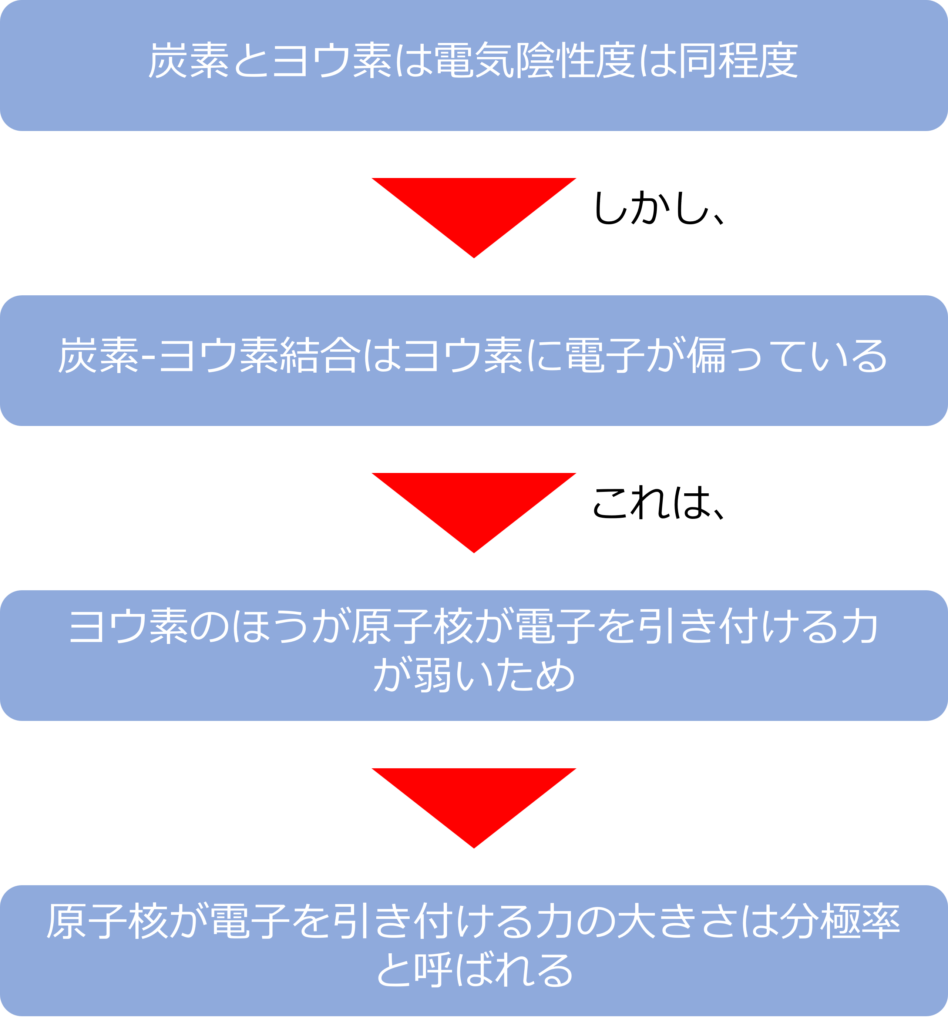
原子核が強く電子を引き付けていない大きな原子は、強く引き付けている原子と比較し、負電荷を帯びやすくなります。
このような電子の引きつけの大きさは分極率と呼ばれ、分極率が高い原子が結合を形成すると電子を引き付け、負電荷を帯びることとなります。
炭素とヨウ素の電気陰性度は同程度の値を示していますが、ヨウ素のほうが分極率が高いため負電荷を帯びやすく、炭素‐ヨウ素の結合では、ヨウ素がδ-、炭素がδ+と極性を持っているかのように振る舞います。
極性反応とは何か
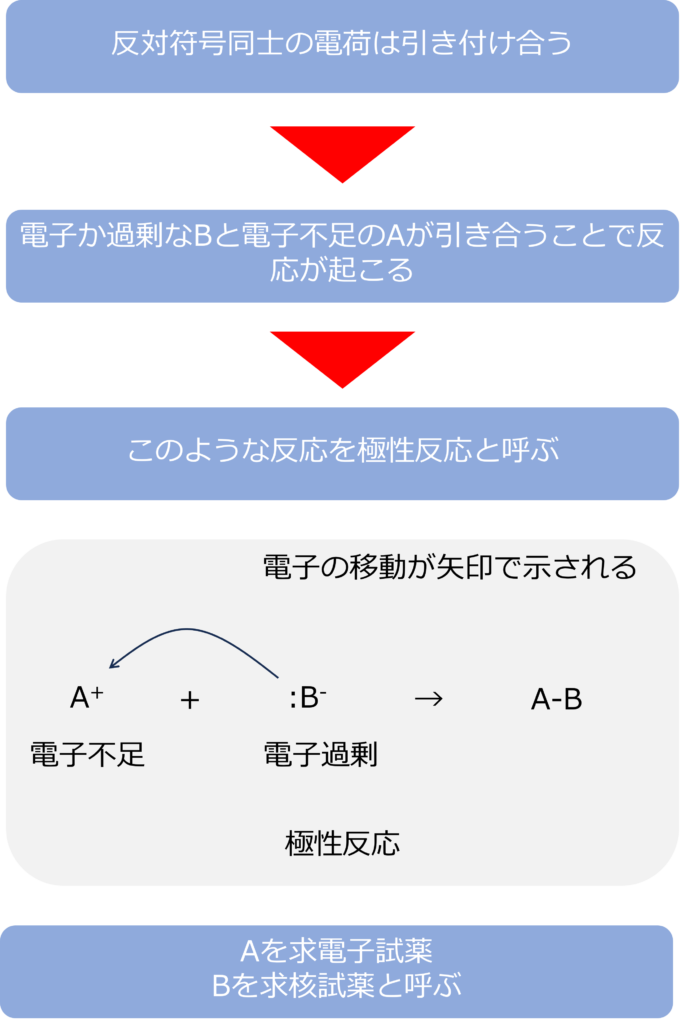
反対符号の電荷同士は引き付け合うという性質を持っています。
極性反応とは分子中の官能基の電子過剰な部分と電子不足な部分が引き合い、反応が起こることです。
極性反応で電子が過剰な物質は求核試薬と呼ばれます。核が正に帯電していることからこのような名称になっており、電子不足の場所に電子を供与することで結合を生成します。求核試薬は中性か負に帯電しています。
電子不足な物質は求電子試薬と呼ばれ、求核試薬から電子を受け取ることによって、結合を作り出します。求電子試薬は中性か正に帯電しています。
極性反応がどのように発生したかは電子の移動を矢印で示すことで記述されます。
化合物は常に求核試薬か求電子試薬のどちらかとして働くのか
ある物質が求核試薬として働くか、求電子試薬として働くかは状況によって変化することもあります。
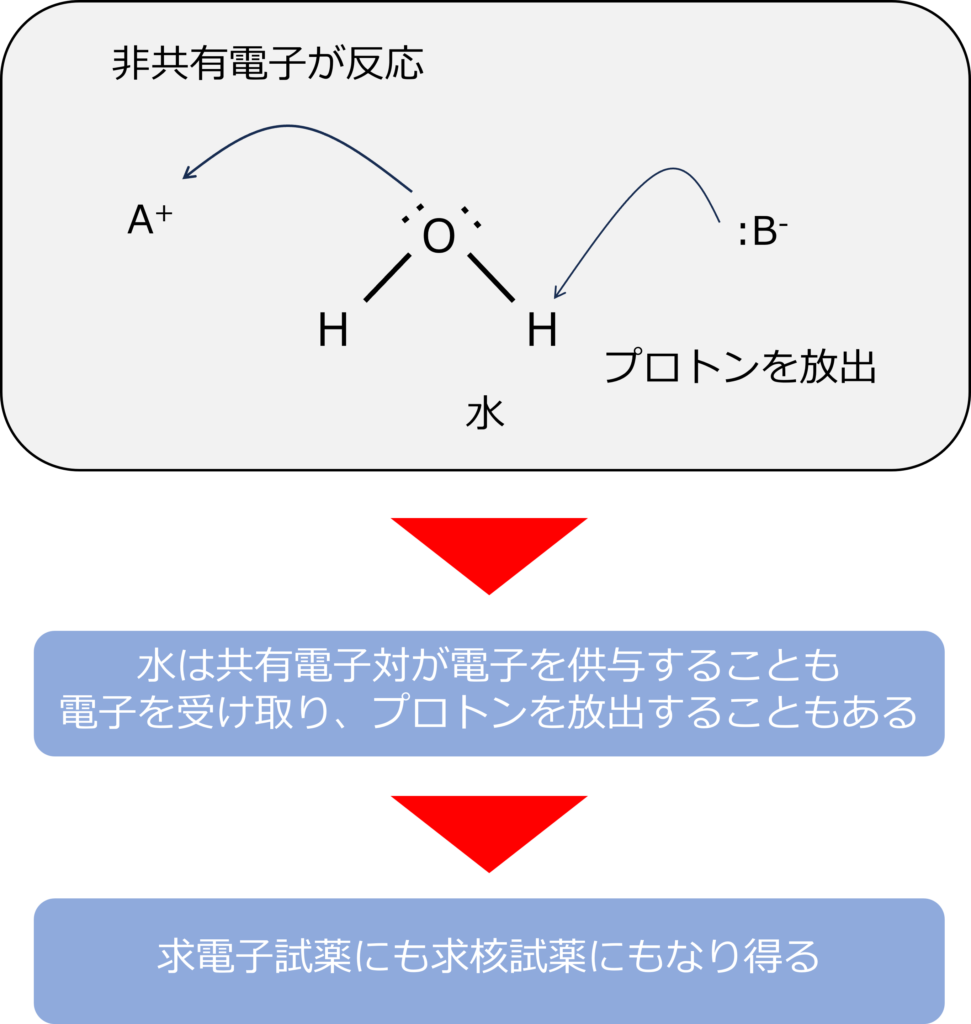
水は求核試薬としても求電子試薬としても働くことがあります。
水の酸素は非共有電子をもっており、この部分の電子を供与する求核試薬として働くこともあれば、水素が電子を受け取ることで、求電子試薬として働くこともあります。


コメント