この本や記事で分かること
・小さすぎる分子や原子をどのようにひとまとまりにするのか
・molとは何か
・濃度の表したかにはどのような表記法があるのか
原子質量単位とは何か
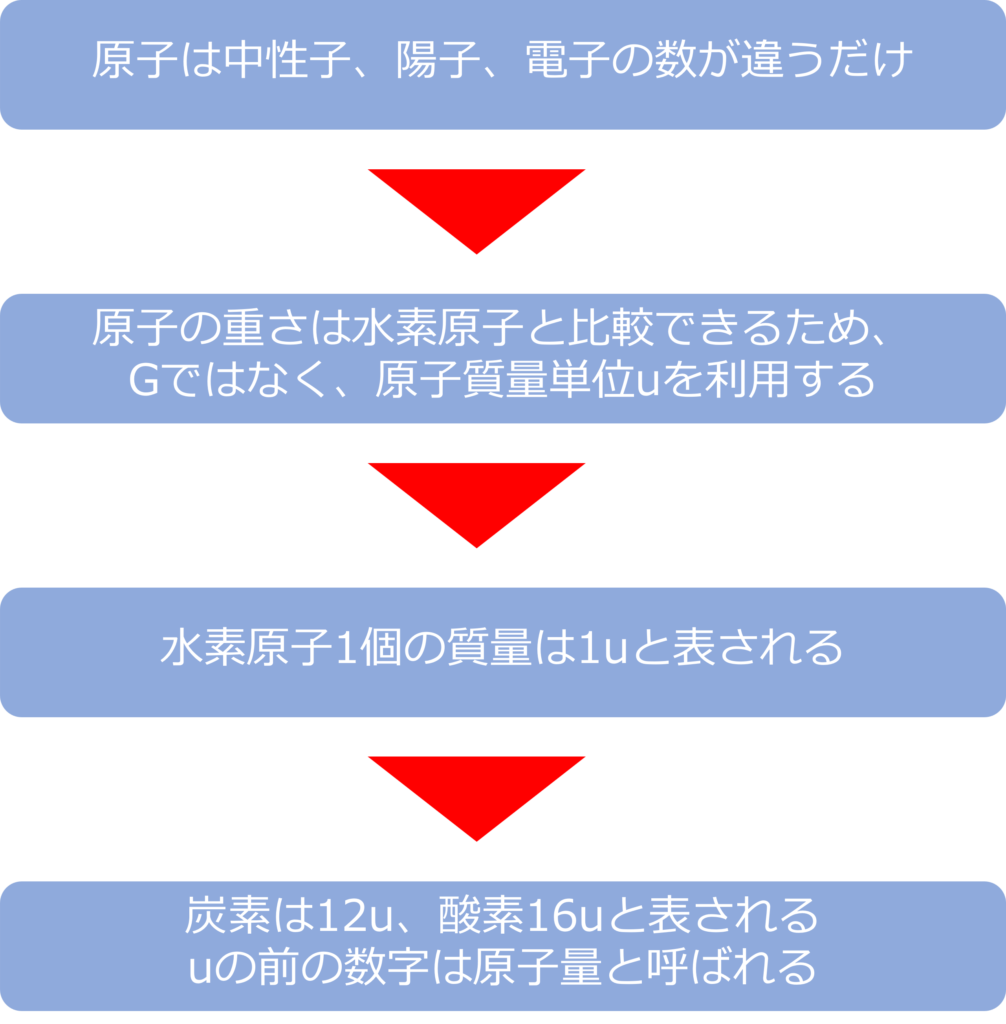
最も軽い元素である水素原子の質量が1.67×10‐24 gとなっていることからも分かるように、一つの原子や分子は非常に小さいものです。
原子一個の重さはgなどではなく、原子質量単位 u を使ってあらわされます。
原子は中性子と陽子、電子からなりたっており、その数が違うだけなので重さは、それぞれの原子の重さは水素原子と比較することが可能です。
水素原子1個の質量は1uと表され、炭素は水素原子12個分、酸素原子は16個分の重さとなるため、それぞれ、12u、16uと記されます。
uの前の数字は原子量と呼ばれます。
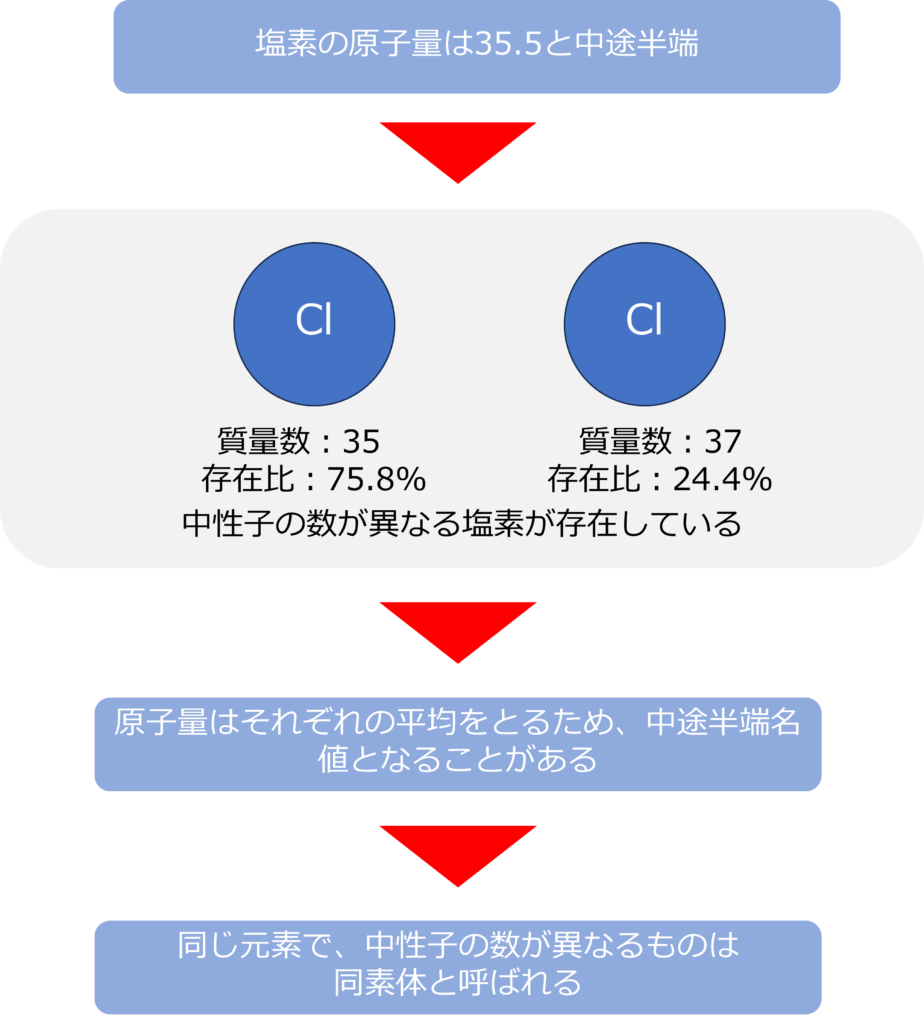
塩素の原子量はなぜ、35.5と中途半端なのか
塩素の原子量は35.5と中途半端な数値になっています。これは塩素には質量数が35と37のものがあり、中性子の数が異なるためです。
自然界には、質量数35の塩素が75.8%、37の塩素が24.2%存在しているため、
35 × 0.758 + 37 × 0.242 =35.5となる、塩素の原子量は35.5となります。
同じ原子で中性子の数が異なるもの同士を同位体と呼び、水素にも中性子を1個持つ重水素や2個持つ3重水素があります。
ただし、水素の場合、水素の存在量が99.9%以上と圧倒的に多くなっているため、原子量1.007と1に近い値となっています。
molとは何か
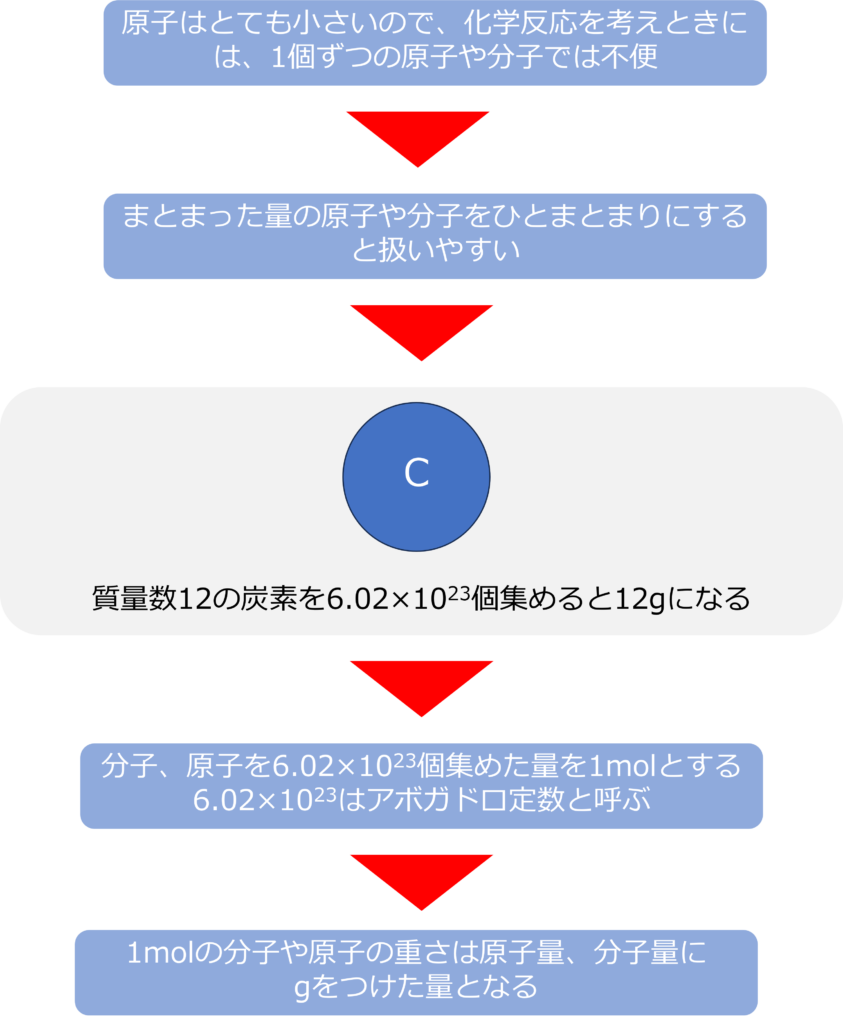
原子質量単位を用いることで、原子、分子の量を把握することは可能ですが、実際に身の回りに起きている反応を考えたり、反応させるときは1個ずつの原子や分子を取り扱うことは不可能です。
そのため、ある程度のまとまった量の原子をひとまとまりにして考えることで取り扱いがしやすくなります。
質量数12の炭素を6.02×1023個集めると12gになることから、分子や原子を6.02×1023個集めた量を1molと呼びます。6.02×1023はアボガドロ定数と呼ばれます。
1molの分子や原子の重さは、原子量や分子量にgを付けた量となり、1molの水素分子(H2)は2g、炭素原子であれば12gとなります。
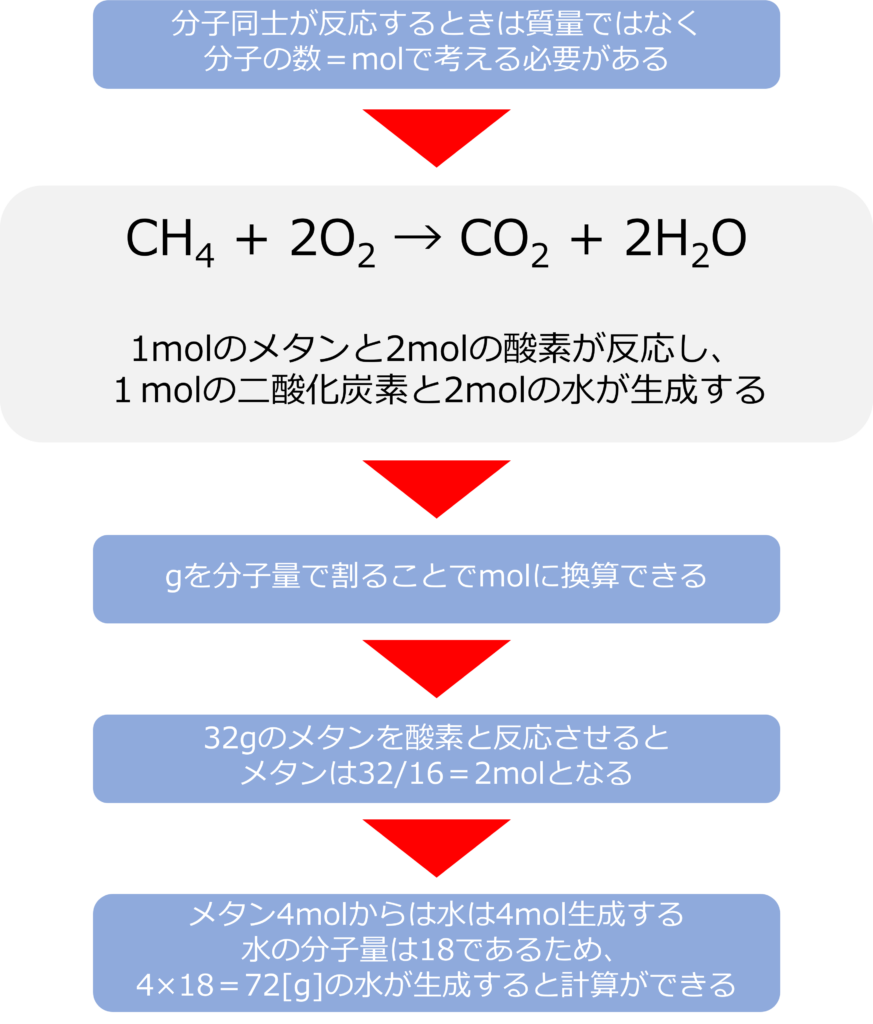
化学反応式は何を表しているのか
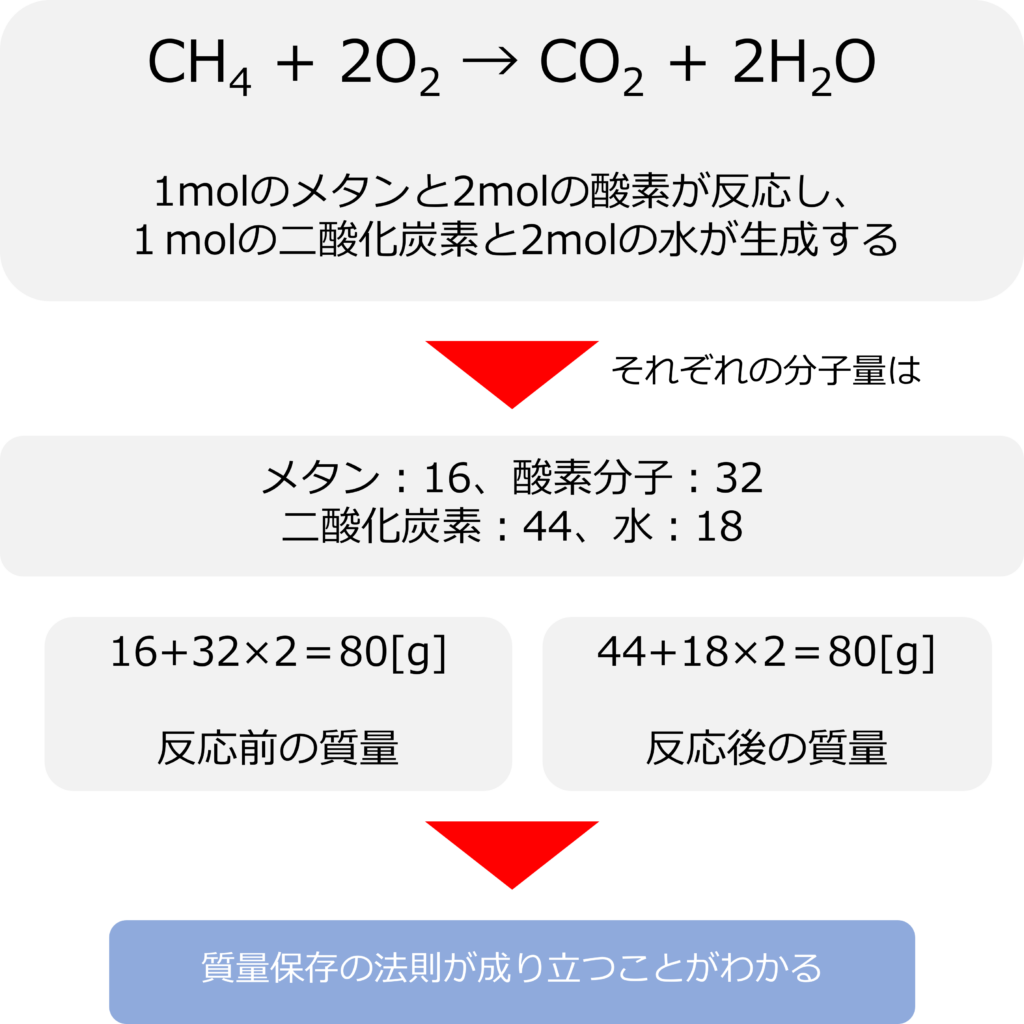
例えば、メタン(CH4)が燃焼(O2と反応)して二酸化炭素(CO2)と水(H2O)になる反応は以下のように記載されます。
CH4 + 2O2 → CO2 + 2H2O
この式は1 mol のメタンが2 molの酸素と反応し、1molの二酸化炭素と2mol の水を生成する反応を表しています。
それぞれの分子の分子量はメタン:16、酸素分子:32、二酸化炭素:44、水:18となるので、
反応前の質量:1 mol のメタン+2 molの酸素=80g
反応後の質量:1 molの二酸化炭素+2 mol の水=80g
となるため、質量保存の法則が成り立つことが分かります。
化学式から生成物の質量はどのように計算されるのか
分子同士が反応する際には、分子同士が反応するため、分子同士がどのくらい反応するかは質量ではなく分子の数(mol)で考える必要があります。
gを分子量で割ることで、分子や原子のmolに換算することが可能です。
CH4 + 2O2 → CO2 + 2H2O
例えば、メタン32gを完全燃焼させたときに、水がどれくらいできるか考えるときは、以下のようになります。
メタンの分子量は16なので メタンの物質量=32/16=2[mol]となります。
2 molのメタンからは4 molの水が生成され、水の分子量は18となるため、4×18=72[g]となり、水は72g生成することが分かります。
溶液の濃度はどのように表されるのか
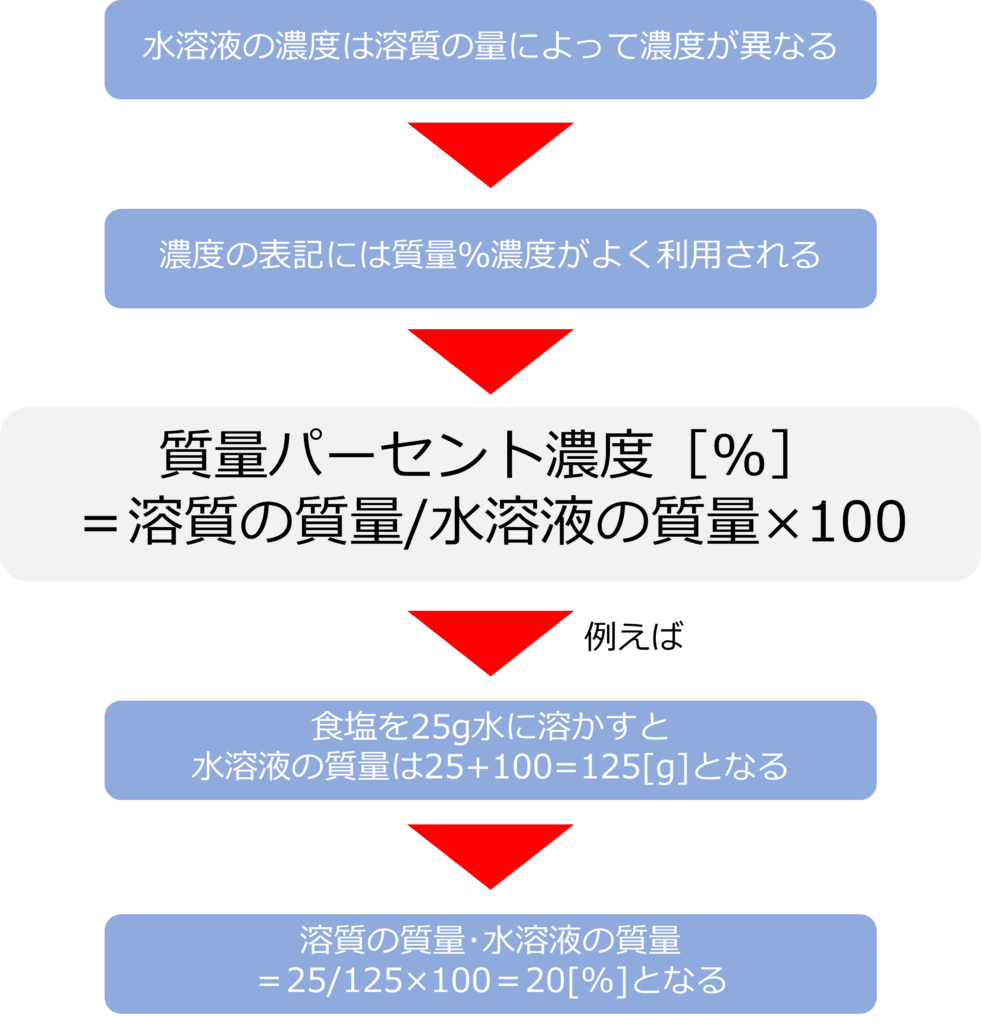
物質を水に溶かした水溶液は、溶けた物質(溶質)の量に応じて、濃度が異なります。
濃度の表記としてよく、利用されるのは、質量パーセント濃度[%]です。
質量パーセント濃度は水溶液全体の重さを100とした時に、溶質の重さがいくつになるかを表したものです。
質量パーセント濃度[%]=溶質の質量/水溶液の質量×100 となります。
例えば、食塩25 gを100gの水に溶かすと、溶質の質量は25g、水溶液の質量は25+100=125gとなり、質量パーセント濃度=25/125×100=20[%]となります。
質量%濃度以外にどのような濃度表記があるのか
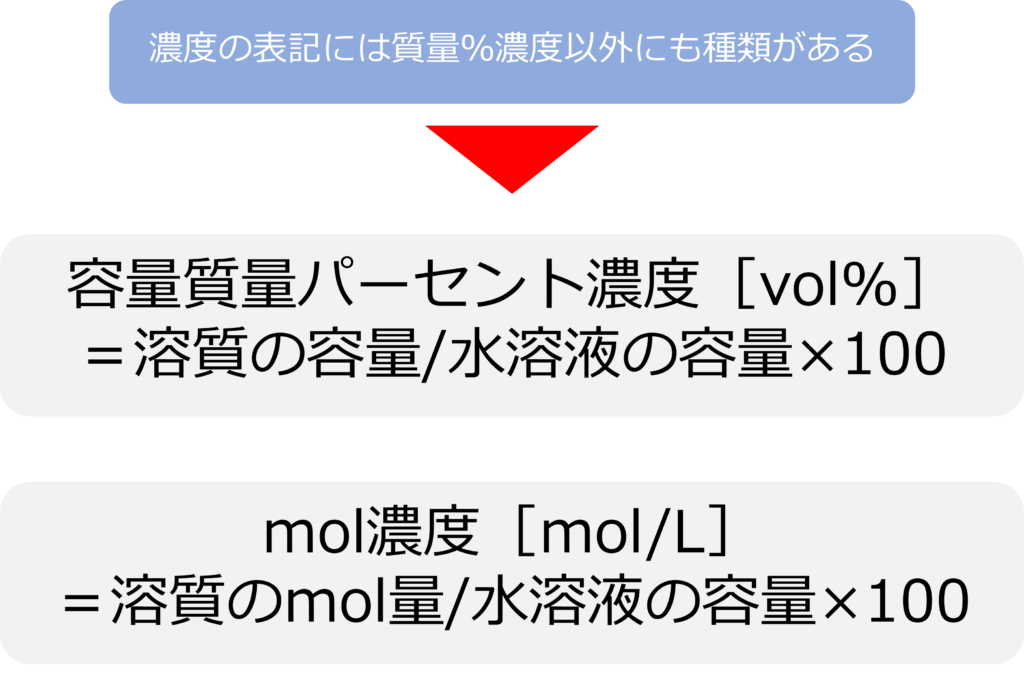
溶液の濃度を示す方法はほかにもいくつかの種類があります。
溶質も液体の場合は容量%濃度が使用されることもあります。
こちらも溶質の質量[g]が容量[ml]に変化しただけであり、
容量パーセント濃度[%]=溶質の容量/水溶液の容量×100 となります。
どちらも%表記となるため、区別するために質量パーセント濃度はwt%やw/w%、容量%はvol%や v/v%と記されることもあります。(wtは質量を意味するweghit volは容量を意味するvolume)
また、溶液の物質量で記載される場合もあり、溶液1L中に含まれる物質量[mol]で示されます。
1Lの水溶液に1molの溶質が溶けているときには、1mol/L、5mol溶けていれば、5mol/Lとなります。
%よりも微量濃度を扱うときにはどのような単位があるのか
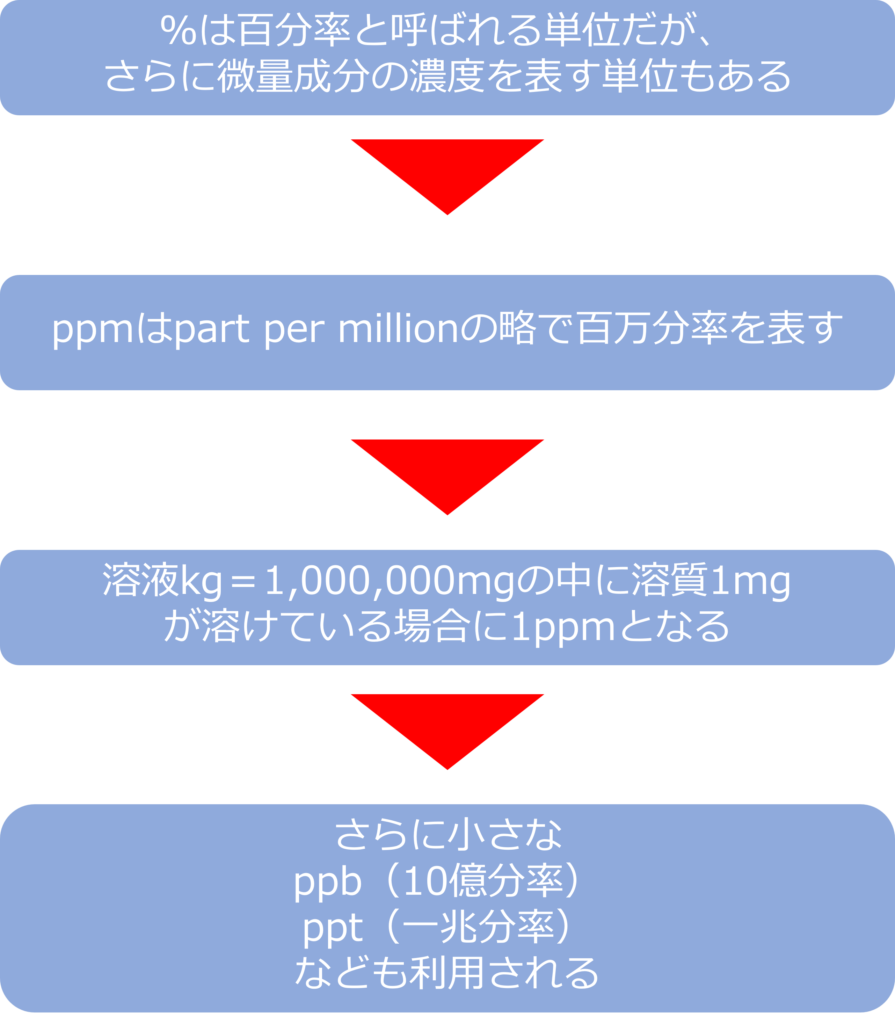
%は100分率と呼ばれる単位ですが、さらに微量成分の濃度を表す単位もあります。
ppmは part per millionの略で、millionは100万なので、百万分率となり、溶液1kg(=1,000,000mg)中に、溶質が1mg溶けている場合に1ppmとなります。
大気汚染物質の濃度や残留農薬、残留塩素など微量濃度を表す際などに用いられています。
近年では分析精度が向上し、さらに小さな濃度を示すppb(10憶分率)、ppt(一兆分率)などが利用される場面もあります。


コメント